Sharon Belvin: "Mein Arzt schlug mir vor, an einer klinischen Studie mit einer Immuntherapie teilzunehmen. Das hat mir das Leben gerettet."
Horst Beck: "Ich war ja austherapiert, weil die Chemotherapie nix mehr genutzt hat, - Ich hab gsagt macht, und seht zu, dass ihr das gut schafft."
Jim Allison: "Als ich sie zum ersten Mal traf, waren ihr Mann und ihre Eltern bei ihr. Sie hatte gerade erfahren, dass sie seit einem Jahr tumorfrei war. Knapp drei Jahre später hat sie mir ein Foto ihres ersten Babys geschickt."
Imogen Cheese: "It gives me hope that I can fight the monster."
Risokobehaftet, aber wirksam: die Checkpoint-Inhibition
"Mein Name ist Horst Beck, mir sin im NCT in Heidelberg und ich hatte oder habe Lungenkrebs, und im Moment bin ich an einer Studie beteiligt, weil die Chemotherapie nicht mehr gholfen hat, deswegen bin ich jetzt hier im NCT, und mache die Studie mit."
Die Ambulanz am Nationales Centrum für Tumorerkrankungen Heidelberg. Horst Beck, ein Mann Ende 60 mit angegrautem Vollbart, sitzt in einem hohen, hellen Behandlungsstuhl. Über einen dünnen Schlauch läuft eine farblose Flüssigkeit langsam in seine Venen hinein. Es ist eine Krebstherapie:
"Es würde mich dann schon irgendwann interessieren, was die mir jetzt so richtig gegeben haben, und was das bewirkt hat. Des wissen die ja selbst net, - noch net, aber jetzt im Moment, ist es einfach: Ich bin da, mir geht’s gut, mein Lebensqualität ist gestiegen, ganz schön gestiegen sogar."
Horst Beck hat vor knapp anderthalb Jahren nicht lange überlegt, als die Ärzte ihm im Rahmen einer Studie eine Immuntherapie anboten. Andere Optionen gab es für ihn ohnehin nicht mehr: "Der kleinzellige Krebs, den ich da hab, das ist halt ein schlimmer, und die hatten no net viel, oder haben gar nix gehabt, hat man ja gesehen, die Chemo hat nachher nix mehr geholfe."
Die neue Therapie schlug an. Die Metastasen in seiner Nebenniere sind verschwunden, seine Lymphknoten im Bauchraum wieder auf Normalgröße geschrumpft, seine Lunge tumorfrei. In seinem ganzen Körper gibt es keine Anzeichen aktiven Tumorwachstums mehr. Das hatten die Ärzte gehofft, aber erwartet hatten sie es nicht. Jürgen Krauss, leitender Oberarzt, überblickt die Studie, in der Horst Beck behandelt wird, und kennt die Datenlage:
"Es ist nicht typisch. Also wenn man sich die Daten mal anschaut, und die besten Daten gibt es eigentlich für den schwarzen Hautkrebs, da überblickt man inzwischen Zeiträume von zehn Jahren. Dann sieht man eigentlich, dass durch diese Therapien Patienten in einer Langzeitremission sind, das heißt, länger als fünf Jahre, das sind so ungefähr 20 Prozent aller Patienten."
Jürgen Krauss zitiert Zahlen zum schwarzen Hautkrebs unter Behandlung Ipilipumab. Nur für dieses Medikament gibt es schon langfristige Daten. Für Patienten, die wie Horst Beck an Lungenkrebs erkrankt sind, und zusätzlich noch das neuere Nivolumab bekommen, haben die Studien gerade erst begonnen. Bisher weiß man nur, dass teils erstaunliche Erfolge möglich sind, aber keiner weiß, wie lange sie anhalten werden, und wie viele der Patienten so gut reagieren werden. Die Mediziner betreten Neuland und das auf breiter Front. Die große Überschrift heißt Immuntherapie, das aktuelle Schlagwort Checkpoint-Inhibition.
Dirk Jäger, geschäftsführender Direktor am Heidelberger Centrum für Tumorerkrankungen: "Das was im Moment Furore macht, das sind die Ansätze der sogenannten Checkpoint-Inhibition. Was man da macht: Man gibt eine Substanz, die sogenannte T-Zell-Antworten verstärkt."
T-Zellen gehen im Körper sowieso gegen krankhaft veränderte Zellen vor, so Jäger: "Und alleine dieser einfache Mechanismus, diese einfache Intervention führt doch zu klinisch erstaunlichen Resultaten. Wir sehen beim schwarzen Hautkrebs, beim Melanom, wir sehen es beim Lungenkrebs, beim Bronchialkarzinom, aber auch beim Harnblasenkarzinom, oder Nierenzellkarzinom, dass eine solche Therapie effektiver, deutlich effektiver sein kann als die bisherige Standardtherapie."
Die Tumorarten, die Dirk Jäger aufzählt, stammen - erstens - aus völlig verschiedenen Geweben und waren - zweitens - bisher extrem schwer zu behandeln. Die Checkpoint-Inhibitoren liefern breit gestreut Erfolge und das gerade in Fällen, wo sonst nichts hilft: Bei Patienten zum Beispiel mit vielen Metastasen, fortgeschrittener Krankheit oder besonders aggressiven, stark mutierten Tumoren. Jäger:
"Das ist schon eine Art Revolution in der Onkologie. Das verändert unsere Therapiestandards sehr rasch und sehr erheblich. Wir werden auf diesem Sektor in Zukunft Kombinationstherapien sehen, wo man mehrere Checkpoint-Inhibitoren miteinander kombiniert, das wird schon ausprobiert, wir sehen wesentlich höhere Ansprechraten, wahrscheinlich auch deutlich längeres Gesamtüberleben, mit solchen Ansätzen, aber auch mehr Nebenwirkungen, mehr Toxizität."
Niemand weiß, ob und wann man die Therapie absetzen kann

Horst Beck hat im Rahmen der Studie eine solche Kombination aus zwei verschiedenen Checkpoint-Inhibitoren bekommen. Inzwischen - mehr als ein Jahr nach Therapiebeginn - bekommt er nur noch einen Wirkstoff als eine Art Erhaltungstherapie. Die Ärzte wissen nicht, ob und wann sie die Therapie absetzen könnten, ohne zu riskieren, dass der Tumor zurückkommt, also wird das Medikament einfach weitergegeben.
Horst Beck ist das auch lieber so, auch wenn er deshalb weiterhin alle 14 Tage in die Krebsambulanz kommen und mehrere Stunden bleiben muss: "Mir ist des sicherer. Ich hab kein Problem damit, weil ich weiß, hier wird mir geholfen, und dementsprechend geht's mir dann wieder besser zuhause."
Zu Beginn der Therapie, kam er das eine Stockwerk bis zu seiner Wohnung kaum noch hoch: "Jetzt komm ich schon mal in den vierten, fünften Stock: Klar, ich blas und puste, aber ich komm hoch. Vorher, ich hab um in die Wohnung zu kommen, hab ich ne Pause gemacht, auf der Treppe, und bin dann wieder weitergelaufen."
Krankenschwester: "So, ich muss Blutdruck messen bei Ihnen."
Die Manschete wird aufgepumpt zum Blutdruckmessen, Piepen vom Fiebermessen, Krankenschwester notiert etwas: "Wo ist denn der Stift?"
Beck: "Da wird geschaut, wie der Verlauf ist, wie ich's vertrag'."
Krankenschwester: "Die Therapie ist jetzt fertig, und wir machen eine Nachbeobachtungszeit von zwei Stunden, um sicher auszuschließen, dass es jetzt noch zu irgendwelchen Nebenwirkungen kommt."
Oberarzt Jürgen Krauss betont gegenüber Patienten immer, dass es mit Immuntherapien noch viel zu wenig Erfahrungen gibt. Gleichzeitig, befeuert durch teils euphorische Medienberichte, schießen die Hoffnungen von Patienten und Angehörigen ins Kraut:
"Es sind ja sehr gehypte Therapien, es ist momentan in aller Munde. Was es aber wirklich bedeutet für den einzelnen Patienten, das ist letztendlich unser Job, dass man den Patienten eine realistische Einschätzung ermöglicht, also dem Patienten zu erklären, die Substanzen sind nicht ungefährlich."
Checkpoint-Inhibitoren können auch solche Immunzellen scharf machen, die sich gegen gesundes Gewebe richten, gegen Darm oder Lunge zum Beispiel. Das sei zwar eher selten, sagt Krauss, doch wenn etwas schief läuft, müssen die Ärzte schnell handeln:
"Wenn sie zum Beispiel eine Autoimmun-Entzündung der Lungenbläschen eine Woche nicht erkennen, das sind ja fehlgeleitete T-Zellen, die auf Strukturen der Lunge losgehen, dann haben sie einen massiven Schaden."
Der andere wichtige Punkt: Es gibt zwar Fälle, in denen die Checkpoint-Inhibitoren spektakulär gut wirken. Doch immer noch wirken sie bei der Mehrheit der Patienten nicht, oder nur schwach oder nur für kurze Zeit. Krauss:
"Wir müssen aufklären, dass der Patient realistisch einordnen kann, in welcher Größenordnung kann ich erwarten, dass mein Tumor positiv beeinflusst wird."
Horst Beck weiß, dass die Therapie, die er bekommt, ernste Nebenwirkungen auslösen kann. Und er weiß, dass keiner weiß, wie lange sie ihm helfen wird. Er erlebt immer wieder, dass Patienten wie er plötzlich nicht mehr da sind:
"Man sieht Leut, denne geht's gut, und dann auf einmal sieht man sie nicht mehr, und dann fragt man nach: 'Ach ja, ist gestorben.' Deswegen, ich fühl mich auch jetzt net sicher. Es ist okay, ich sag mir, wenn es zurückkommt, kommt's zurück, da kann ich nix mache, aber erst amal, sag ich, das Ding ist Bombe, was se dir da neischaffe."
Impfungen gegen Krebs: Ein Ansatz mit Geschichte
Die Idee, das Immunsystem gegen Tumoren in Stellung zu bringen, ist alt. Vor gut hundert Jahren schlug Paul Ehrlich vor, ähnlich wie bei Infektionskrankheiten Antikörper gegen Tumoren einzusetzen oder gegen Krebs zu impfen. Viele Jahrzehnte lang folgte Rückschlag auf Rückschlag, kein Ansatz wollte so recht fruchten. Doch dann wurden vor allem die Methoden besser. Und es zeigte sich: Paul Ehrlich war auf der richtigen Spur, wie Dirk Jäger ausführt:
"Wir wissen, dass das Immunsystem jeden Tag in uns allen hundertfach entstandene Tumorzellen als Tumorzellen erkennt und die sehr effektiv abtötet."
Genau wie gegen Bakterien- oder Vireninfektionen setzt das Immunsystem gegen Tumorzellen alles ein, was ihm zu Verfügung steht. Und das ist eine Menge, meint Jäger:
"Ich vergleiche es immer gern mit einer akuten Organabstoßungsreaktion. Wenn ein Patient beispielweise eine Leber transplantiert bekommt, ein kilogrammschweres Organ, und es kommt zu einer akuten Abstoßungsreaktion, dann ist das Immunsystem des Patienten in der Lage ein kilogrammschweres Organ in einer Nacht komplett zu vernichten, komplett zu verflüssigen. Aber nur die transplantierte Leber und nicht andere Teile des gesunden Körpers. Das heißt, das Immunsystem, wenn es denn mal effektiv funktionieren kann, ist extrem spezifisch, und extrem potent."
Doch manchmal entgehen kranke Zellen dem Angriff: "Wenn ein paar dumme Zufälle zusammenkommen, kann es passieren, dass Zellen entstehen, die sich einer Immunerkennung entziehen, und aus solchen Zellen kann dann ein Tumor wachsen. Die Immunantwort ist nicht mehr stark genug, oder die Mechanismen, die der Tumor benutzt, um sich dieser Antwort zu entziehen, sind relativ clever geworden. Er maskiert sich und macht sich für das Immunsystem weniger gut sichtbar."
Das Immunsystem, so kann man das sehen, braucht in solchen Fällen Hilfe, um doch noch die Oberhand über die Tumorzellen zu gewinnen. Man muss es wieder scharfmachen. - Die Frage ist nur: wie?
Wie tricksen Krebszellen das Immunsystem aus?
"Mich fasziniert das Immunsystem, weil es uns dermaßen gut vor allem Möglichen schützen kann."
Jim Allison vom MD Anderson Cancer Center der Universität von Texas in Houston war einer der ersten, der auf diese Frage eine Antwort fand. Dabei hat er sich anfangs gar nicht so sehr für Tumoren interessiert:
"Dieses wunderbar komplexe System aus verschiedenen Immunzellen, die im Körper herumwandern, miteinander kommunizieren und fast alles bekämpfen können, was die Natur uns so um die Ohren schlägt: Die T-Zellen wurden gerade erst entdeckt - Anfang der 1970er war das. Das interessierte mich."
T-Zellen, so viel weiß man heute, sind Immunzellen, die wie Wachsoldaten durch die Blutbahnen und das Gewebe patrouillieren, und nach Eindringlingen, Verletzungen oder geschädigtem Gewebe suchen. Sie nutzen dabei bestimmte Erkennungsmerkmale gefährlicher Zellen. Werden sie fündig, beginnen sie - erstens - sich schlagartig zu vermehren, rufen - zweitens - weitere Zellen des Immunsystems zu Hilfe und beginnen - drittens - die fehlerhaften, fremden oder von Viren befallenen Zellen zu töten. Schließlich legen sie im Gedächtnis T-Zellen-Archive an, die, wenn ähnliche Eindringlinge wiederauftauchen, schnell und effektiv eine neue Immunantwort auslösen können, erklärt Allison:
"Ich dachte, man könnte diese T-Zellen gegen Krebs richten. Der erste Schritt war, dass wir herausfanden, woran sie erkennen, was fremd und gefährlich ist. Dann sahen wir: Damit sie aktiv werden, reicht es nicht aus, dass sie auf etwas Fremdes stoßen. Sie brauchen bestimmte Signale, durch die sie aktiviert werden. Die bekommen sie von anderen Zellen. Sobald dann alles läuft, wird schon wieder eine molekulare Bremse gezogen, die dafür sorgt, dass sich die T-Zellen wieder abschalten. Es gibt also eine ganze Reihe von Checkpoints, die sicherstellen dass die T-Zellen nicht unkontrolliert wüten. Sonst würden wir von unserem eigenen Immunsystem zerstört."
Wenn Tumoren das Immunsystem austricksen, nutzen sie offenbar oft genau diese Sicherheitsvorkehrungen für sich aus. Sie maskieren ihre Identität, Sie signalisieren den T-Zellen: "Das hier ist gesundes Gewebe, keine Aktivität notwendig." Sie blockieren wichtige Aktivierungssignale oder klemmen die Bremsen fest.
Nach vielen Fehlversuchen fand Jim Allison heraus: der beste Weg, eine blockierte T-Zell-Antwort wieder in Gang zu setzen, ist, die Bremsen zu lösen. Es gelang ihm, das Molekül zu finden, das die Bremse kontrolliert, und diese Schaltstelle namens CTLA-4 zu blockieren. Der Effekt:
"Wir machten die ersten Versuche natürlich in Mäusen. Wir injizierten ihnen diesen einen Antikörper. Und tatsächlich wurden ihre T-Zellen aktiv und die Tumoren verschwanden. Der Wirkstoff heißt Ipilipumab, es war der erste Checkpoint-Inhibitor überhaupt. "
Die erste, klein angelegte Patientenstudie machte Allison mit Melanom-Patienten, deren Tumor schon sehr weit fortgeschritten war. Eigentlich nur um nachzuweisen, dass der Wirkstoff für Menschen ungefährlich ist:
"Die Studie begann 2001. Wir hatten nicht damit gerechnet eine klinische Wirkung zu sehen. Doch von den 14 Patienten, die wir behandelten, schrumpften bei dreien die Tumoren. Das war sehr ungewöhnlich. Damit war klar, dieser Wirkstoff ist anders als andere."
Weitere klinische Studien wurden aufgelegt, der Wirkstoff an mehr Patienten getestet. Zu ihnen gehörte auch Sharon Belvin. Das war 2006, da war sie gerade Anfang 20. Jim Allison erinnert sich: "Ihre Diagnose war schwarzer Hautkrebs, Stadium vier, also mit Metastasen. Alle Therapien hatten bei ihr versagt, auch die experimentellen. Nichts funktionierte."
Sharon Belvin bekam den neuen Wirkstoff am Memorial Sloan Kettering Cancer Center in New York unter Aufsicht eines Kollegen von Jim Allison. Den Forscher traf sie erst, als sie die Therapie schon einige Monate lang hinter sich hatte, berichtet sie:
"Mein Arzt fragte mich, ob ich denjenigen kennenlernen wollte, der die Therapie entwickelt hatte. Natürlich wollte ich! Das war eine verrückte Szene: ich bin groß und temperamentvoll. Jim Allison dagegen zurückhaltend, ein stiller Mann. Er kam zur Tür herein, und ich habe ihn einfach umarmt. Ich habe ihn fast überrannt.

Ich war völlig durcheinander. Ich hatte ja eben erst erfahren, dass ich mein Melanom offenbar wirklich überstanden hatte, und er war es, der dafür das Mittel gefunden hatte."
Patienten wie Sharon Belvin gibt es inzwischen viele. In den USA nennt man sie Super-Survivor. Sie haben Krebserkrankungen überlebt, die als unheilbar galten, und viele sind auch noch zehn Jahre später tumorfrei. Diese frühen Erfolge wurden alle mit Ipilipumab erreicht, das Jim Allison entwickelt hatte. Inzwischen gibt es eine zweite Generation von Wirkstoffen, sie funktionieren ähnlich wie Ipilipumab, setzen aber an anderen Checkpoints an. Nivolumab ist das Bekannteste, seit Juni 2015 ist es in Deutschland offiziell erhältlich. In den Entwicklungslabors der Pharmaindustrie wird unterdessen fieberhaft weitergearbeitet. Zehn, zwölf Wirkstoffe sind in der Pipeline. Der Hype ist da, eine Art Goldgräberstimmung. Jim Allison:
"Die Ergebnisse aus klinischen und präklinischen Studien mit neuen Substanzen und neuen Kombinationen kommen gerade so schnell raus, dass wir Forscher nicht mehr hinterherkommen. Das ist beschämend: Bei vielen Wirkstoffen, die gerade durch die Entwicklungsstufen für Medikamente gebracht werden, haben wir keine Ahnung, warum und wie sie funktionieren."
Vieles ist weiter ungeklärt
Immer neue Varianten einiger ähnlicher Wirkprinzipien auf den Markt zu bringen, damit ist es aber nicht getan. Entscheidende Fragen bleiben offen: Warum nutzt die Behandlung zum Beispiel mit Ipilipumab nur einem von fünf Melanom-Patienten? Wie gut wirken Kombinationstherapien aus zwei oder mehr Checkpoint-Inhibitoren? Warum sprechen manche Tumortypen gar nicht oder nur schlecht auf Checkpoint-Inhibitoren insgesamt an, zum Beispiel in Darm, Brust oder Prostata, und wie lässt sich das ändern?
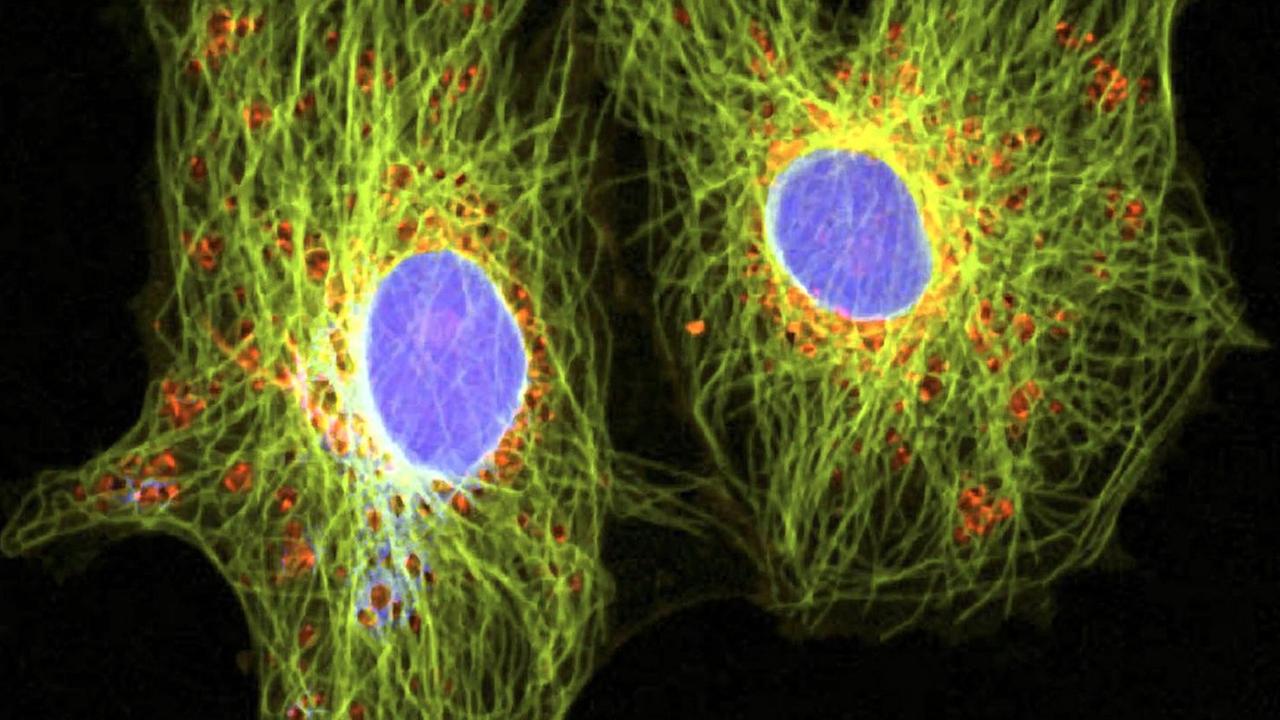
Patrick Schmidt: "So, wir haben hier die Bilder von diesen, wir nennen sie 'explants'. Das sind kleine Tumorstückchen aus einer Biopsie, die wir 24 Stunden in Kultur genommen haben, und drauf haben wir T-Zellen gegeben."
Im Labor des NCTs in Heidelberg zeigt der Biologe Patrick Schmidt auf eine Mikroskop-Aufnahme. Das Tumorgewebe ist blau gefärbt. Um den blauen Fleck herum sitzen grün gefärbt viele kleinere, runde Zellen. Das sind die T-Zellen:
"Normalerweise wandern T-Zellen durch das Gewebe, checken alles ab. Sollte was sein, zerstören sie's. In dem Fall tun sie's aber nicht, sie werden vom Tumor gehindert, indem der Tumor eine Barriere aufbaut und sagt: hier geht es nicht durch."
Patrick Schmidt interessiert, wie der Tumor diese Botschaft formuliert. Für das Tumorstück im Bild kann er die Frage beantworten: "In dem Falle nutzt der Tumor ein Signal, was sehr gut für gesunde Menschen ist. Ein gesunder Mensch möchte nicht, dass seine T-Zellen dauernd irgendwo einwandern."
Das Signal heißt PD-L1 und wird von T-Zellen über ihre PD1-Rezeptoren erkannt. Gesundes Gewebe schützt sich mit diesem Signal davor, von T-Zellen angegriffen zu werden. Genau hier setzt die zweite Generation von Checkpoint-Inhibitoren an, unter anderem Nivolumab, so Patrick Schmidt:
"Wenn das der Mechanismus ist, der die T-Zellen draußen hält, dann spricht das natürlich sehr stark dafür, dem Patienten auch diese Mittel zu geben, um seine T-Zellen wieder zu aktivieren."
Der Patient, von dem die Probe stammt, würde ziemlich sicher gut auf Nivolumab ansprechen. Ist PD-L1 im Tumorgewebe aber gar nicht vorhanden, kann das Medikament dem Patienten auch nichts nützen. Das Milieu aus Signalstoffen und Erkennungsmolekülen in und um den Tumor nennen die Forscher Mikroumgebung. Sie variiert stark von Patient zu Patient und von Gewebe zu Gewebe. Wer verstehen will, warum manche Tumoren ansprechen, andere nicht, muss hier weiterforschen, erklärt Niels Halama, auch er arbeitet am NCT in Heidelberg:
"Man muss ehrlicherweise gestehen, dass wir wahrscheinlich nur einen winzigen Bruchteil von dem verstehen, was dort wirklich passiert. Diese Komplexität irgendwie zu begreifen, ist etwas, was ein wichtiger Weg ist, weil es die Tür öffnet für eine zielgerichtete Therapie."
Bisher werden die Immuntherapien quasi blind gegeben. Der Patient lässt sich auf ein Experiment mit hohem Risiko ein.
Patrick Schmidt verfolgt noch einen ganz anderen Ansatz. Statt mit Checkpoint-Inhibitoren bestimmte Bremsen des Immunsystems ganz zu lösen, versucht er die T-Zellen selbst genetisch zu verändern: "Was wir hier in der Zellkulturflasche haben, ist, ich sag mal, eine trübe Suppe von Zellkulturüberstand."
Der junge Forscher hält eine durchsichtige, flache Plastikflasche in der Hand: "Am Flaschenboden kann man auch noch erkennen, wenn man es ein bisschen gegen das Licht hält: Diese kleinen Punkte, die man dort sieht, das sind kleine Nester von Tumorzellen, die sich abgesetzt haben."
Die Zellen stammen aus Flüssigkeit, die sich in den Lungen einer Brustkrebspatientin angesammelt hat. Schmidt kann im Mikroskop erkennen, dass die T-Zellen zwar registrieren, dass hier etwas nicht stimmt, und sich um die Tumorzellen herum ansammeln, aber sie tun nichts. Offenbar erkennen sie nicht, wo sie angreifen könnten:
"Was wir machen ist, wir schleusen ein neues Gen ein wir brauchen dazu Vektoren, wir nennen sie auch Genfähren. Das sind Lentiviren, denen wir ein neues Gen einpflanzen, und dieses Gen wird dann übertragen in die T-Zelle durch diese Genfähren."
Das eingeschleuste Gen kodiert für einen künstlichen Rezeptor, mit dem die T-Zellen die Tumorzellen dann besser erkennen. In der Zellkultur in der Plastikflasche klappt das auch, so Patrick Schmidt:
"Am schönsten ist dann immer zu sehen, wenn man so ein Experiment ansetzt und nach zwei Tagen auswertet, und man sieht auch schon im Mikroskop tote Tumorzellen, oder überhaupt gar keine Tumorzellen mehr, und man weiß schon: Das hat funktioniert."
Zellen wie die von der Brustkrebspatientin sind bisher aber nur für Experimente im Labor vorgesehen: "Allerdings haben wir andere Settings, mit T-Zellen gegen Tumorzellen, die schon näher dran sind an der Klinik. Wir bereiten eine klinische Studie vor. Wir hoffen, wenn alles gut läuft, die Aufsichtsbehörden zustimmen, dass das Anfang nächsten Jahres losgehen kann. Das sind in dem Fall keine Brustkrebspatienten, sondern Leukämie- und Lymphompatienten."
Es ist kein Zufall, dass Patrick Schmidt sich zunächst auf Blutkrebsarten konzentrieren will, denn der Tumor sitzt in diesen Fällen dort, wo auch die veränderten T-Zellen zuerst hinkommen, eben im Blut. In den USA gab es mit dieser Methode, den sogenannten CAR-T-Zellen, Erfolge vor allem bei Leukämien.
Doch auch einzelne Todesfälle hat es gegeben, die klar durch die Therapie verursacht wurden, sagt Hinrich Abken von der Universität Köln. Er war einer der ersten überhaupt, der diese Methode vorangetrieben hat. Die Krux, sagt er, sei auch hier: Wie macht man die CAR-T-Zellen möglichst agressiv, ohne dass sie gleich auch auf gesundes Gewebe losgehen? Hinrich Abken:
"Das ist zurzeit die große Frage, wie kann man die Selektivität für die Tumore erhöhen, ohne dass das Normalgewebe angriffen wird."
Die Regeln für die Zulassung erster kleiner klinischer Studien sind hierzulande viel strenger als in den USA, sagt Abken. Auch er ist dabei eine erste, kleine klinische Studie anzuschieben:
"Mittlerweile sind über 50 Studien mit CAR-T-Zellen in den USA aktiv. In Europa gibt es einige Anmeldungen, einige kleine Pilotstudien sind gelaufen, der große Durchbruch ist in Europa noch nicht gewesen. Die Genehmingungsprozesse müssen in Europa erst einmal alle Instanzen durchlaufen und dann können wir starten, hoffentlich bald."
"Die Entwicklung ist rasant"
Die Immuntherapie ist ein Feld im Aufbruch. Die Checkpoint-Inhibitoren verändern die Therapie bei vielen Tumorarten sehr rasch und sehr nachhaltig. CAR-T-Zellen sind noch ein Stück weiter davon entfernt zum Therapiestandard zu werden, aber auch hier ist die Entwicklung rasant. Parallel läuft, mehr oder minder geräuschlos, noch das Konzept der Krebsimpfung.
Auch hier kommen neue Methoden in die Klinik. Offen ist bisher noch die Kostenfrage: Nivolumab allein kostet zum Beispiel pro Patient und Jahr rund 100.000 Euro. Klar ist, die Preise müssen runter und die Medikamente gezielter eingesetzt werden, wenn das Gesundheitssystem unter den Kosten nicht kollabieren soll. Und ob, wie so oft in der Onkologie, die hochfliegenden Hoffnungen doch noch enttäuscht werden, kann nur die Zeit zeigen. Sicher ist: für die Patienten hat sich schon jetzt viel verändert.
Imogen Cheese: "Als Patientin, bei der schon ein Melanom entfernt wurde, muss ich immer mit einem Rückfall rechnen, und mit den bisherigen Medikamenten waren meine Aussichten ziemlich düster. Deshalb verfolge ich genau, was es Neues gibt. Diese neuen Substanzen, die so überraschend gut wirken, sind extrem wichtig für mich. Das erzeugt bei uns allen sehr viel Hoffnung."
Horst Beck: "Ich hab' jetzt im Juni Geburtstag. Da hab' ich ne Grillhütte gemietet. Ich hab aber die Grillhütte auch schon für nächstes Jahr gemietet, und auch schon bezahlt."
Es sprachen: Maria Hartmann, Robert Frank und Lisa Hrdina
Ton: Inge Görgner
Regie: Friederike Wigger
Redaktion: Christiane Knoll
Ton: Inge Görgner
Regie: Friederike Wigger
Redaktion: Christiane Knoll
Deutschlandfunk 2016