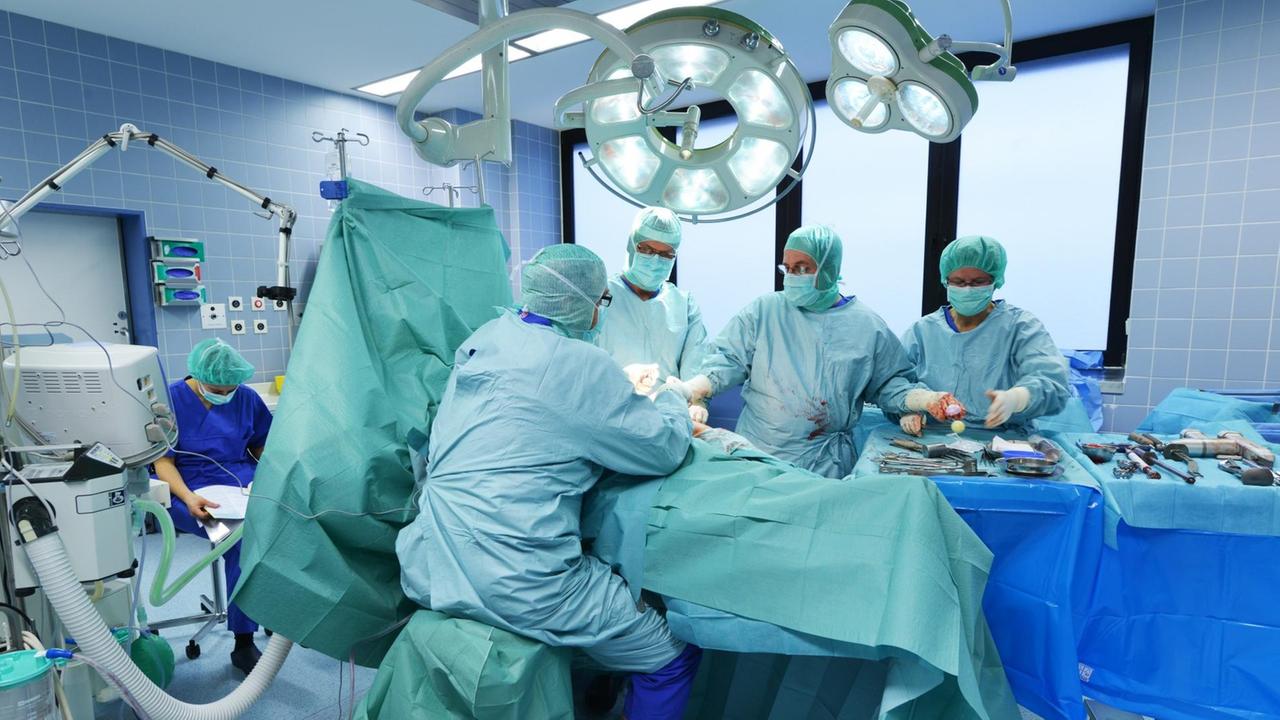
Thomas Woska und seine Frau Karen gehen an der Ems in Papenburg in Niedersachsen spazieren. Auf der Werft gegenüber werden Kreuzfahrtschiffe gebaut. Thomas Woska hat bis vor ein paar Jahren dort noch als Schlosser gearbeitet. Bis er nicht mehr konnte.
"Wenn Sie da auf der Meierwerft sind, da laufen Sie also 10, 15 Kilometer am Tag. Man hat immer eine große Werkzeugkiste bei sich, da müssen Sie immer Vollgas geben, und das ging nicht mehr. Also ich war nachher fertig. Ich konnte nicht mehr."
Thomas Woska hat 2013 einen Bandscheibenvorfall und lässt sich in einem Krankenhaus in Leer untersuchen.
"Und der gute Doktor da sagte: Tja, Herr Woska, wir müssen Sie operieren."
Er lässt sich vom Arzt in Leer eine künstliche Bandscheibe einsetzen. Eine Prothese der britischen Firma Ranier, ziemlich neu auf dem Markt. Seine Rückenschmerzen sind danach erstmal weg.
"Nur, dann ging das wieder los. Das war schleichend halt. Und dann nachher kamen die Schmerzen in den Beinen dazu. Das war ganz extrem."
Warnung nach der OP
Fast zwei Jahre nach der OP bekommen die Woskas Post vom Klinikum Leer. Es ist eine Warnung, eine dringende Sicherheitsinformation. Der Verdacht: Die Prothese sitzt nicht fest und kann Lähmungen verursachen, wenn sie auf den Nervenkanal an der Wirbelsäule drückt. Es folgen jede Menge Untersuchungen, bis feststeht: Thomas Woska muss wieder operiert werden. Die künstliche Bandscheibe muss raus.
"Er sitzt ja im Grunde wie auf so einem Pulverfass. Dass da mal irgendwie was wegrutscht - und dann war es das."
Herausholen soll die Prothese der Chirurg Karsten Ritter-Lang aus dem Klinikum Stenum bei Bremen. Er weiß, was sich in Thomas Woskas Rücken abspielt. Er hat inzwischen 70 Patienten die künstliche Bandscheibe wieder entfernt.
"Ab Ende 2015 poppte das dann richtig auf, da kamen dann wirklich Patienten, die dann auch richtig Probleme hatten. Die Prothesen waren zum Teil zerfallen, die Kerne zerstört, das Kunststoffmaterial in Rückenmarkkanal ausgetreten ist."
Auch bei Thomas Woska ist die Prothese völlig zerstört.
"Da kommt jetzt schrittweise dieses weiße Zeug zum Vorschein, als ob man einen alten Kaugummi rauszieht."
Nach eineinhalb Stunden ist es vorbei. Thomas Woska hat eine neue Bandscheiben-Prothese eingesetzt bekommen – eine, die halten soll. Der Arzt, der die fehlerhafte Prothese im Klinikum Leer eingesetzt hatte, ist inzwischen wegen Körperverletzung in 59 Fällen angeklagt.
Sein Anwalt bestreitet die Vorwürfe: Die Prothese sei ja geprüft gewesen. Insgesamt haben in Leer 114 Menschen die fehlerhafte Prothese eingesetzt bekommen. Dazu kommen noch einmal gut 50 Bandscheibenpatienten in Belgien, den Niederlanden, der Schweiz, und Großbritannien.
"Ein No-Go-Implantat"
Auch Doktor Ritter-Lang in Stenum war die Prothese einmal von der Firma Ranier angeboten worden: "Das ist also üblich, dass die Firmen anfragen und dann Produkte vorstellen. Ich hab mir das dann angeschaut und hab auf Grund des Designs Zweifel gehabt, ob dieses Implantat überhaupt in der Lage ist, sozusagen in dem menschlichen Körper einzuheilen. Für mich dann eben ein No-Go-Implantat. Ich hätte es nie angewendet."
Dass die Prothese in Deutschland überhaupt auf den Markt kommen durfte, hat eine private Prüfstelle in Großbritannien erlaubt: BSI. Sie ist vergleichbar mit dem TÜV in Deutschland und ist nach den EU-Regeln dazu berechtigt, ein Zertifikat zu vergeben – das CE-Siegel, das auch auf Toastern oder Kinderspielzeug klebt, und das bedeutet: Dieses Produkt darf in der EU verkauft werden.
Keine systematische Prüfung
"Wenn wir die Ansprüche, die Anforderungen anlegen würden, wie wir sie für Arzneimittel haben, dann muss man sagen, fällt das weit dahinter zurück."
Jürgen Windeler leitet das IQWIG in Köln, das Institut, das offiziell in Deutschland bewertet, was im Medizinbereich wirksam und sinnvoll ist.
"Also der Patientennutzen in geeigneten Studien wird eigentlich vor der CE-Zertifizierung, die ja so etwas wie der Markteintritt für Medizinprodukte ist, nicht wirklich systematisch geprüft."
Die Firma Ranier ließ zwar eine Studie machen, um für ihre künstlichen Bandscheiben das CE-Siegel zu bekommen. Die Prothese wurde dafür aber nur an 29 Patienten ausprobiert. Nach drei Monaten wurden die untersucht, Ranier reichte die Ergebnisse ein und bekam damit das CE-Siegel.
Trotz Warnung weitere Implantationen
Der damalige Geschäftsführer versichert auf Anfrage, die Prothese sei umfangreich und den Gesetzen entsprechend getestet worden. BSI erklärt, geschultes Personal habe eine gründliche Prüfung vorgenommen. Doch allen Teilnehmern der Studie, bei denen es sich nachvollziehen lässt, musste die Prothese später entfernt werden.
In der Klinik in Leer wurde nach einigen der Explantationen noch monatelang weiter verwendet. Ein Schnellwarnsystem, das die Kliniken sofort informiert, gibt es nicht. Äußern möchte sich das Klinikum Leer zu dem gesamten Fall nicht - wegen laufender Ermittlungsverfahren.
Medizinprodukte helfen Patienten und können Leben retten. Immer wieder haben fehlerhafte oder untaugliche Produkte in den vergangenen Jahren aber auch Menschen geschadet: Operationsroboter, die Patienten verkrüppelten. Gefäßstützen im Kopf, die Schlaganfälle begünstigten. Implantierte Defibrillatoren, die ohne Anlass Elektroschocks verpassten.
Vier Millionen Vorfälle
Die Recherchen, die WDR, NDR und Süddeutsche Zeitung zusammen mit dem Internationalen Konsortium Investigativer Journalisten in Washington durchgeführt haben, zeigen: Allein in den USA wurden in den letzten fünf Jahren etwa vier Millionen Vorfälle mit Medizinprodukten gemeldet. Dort sind die Meldungen öffentlich einsehbar. In hunderttausenden dieser Verdachtsfälle gab es Verletzte, in tausenden Fällen auch Tote.
Zwar ist durch die Meldungen nicht bewiesen, dass die Schäden direkt durch ein Medizinprodukt auch ausgelöst wurden, die Recherche zeigt aber auch: Es gibt eine hohe Dunkelziffer. Gerade in Deutschland wird offensichtlich nur ein Teil der Fälle überhaupt gemeldet. Auf die Einwohnerzahl umgerechnet gab es etwa 15mal weniger Meldungen als in den USA.
Widerstand gegen staatliche Zulassungsstelle
"Ich war und bin davon überzeugt, dass Implantate oder andere Medizinprodukte ebenso wichtig sind wie Arzneimittel, und deshalb genauso sicher geregelt werden müssen. Und ich hatte den Ehrgeiz, das zu tun."
Dagmar Roth-Behrendt hat 25 Jahre lang für die SPD im Europaparlament gesessen. Ihr Ziel war ein neues Zulassungssystem für Medizinprodukte. Zentral in der Hand einer EU-Behörde, genau wie für Arzneimittel.

"Bürokratie rettet keine Menschenleben, sondern gezielte Kontrollen an der Stelle, wo es nötig ist."
Peter Liese sitzt für die CDU im Europaparlament. Auch er war damals für strengere Kontrollen vor Ort bei den Herstellern, als Reaktion auf den Skandal um die französische Brustimplantate-Firma PIP. Aber Peter Liese wollte anders als Dagmar Roth-Behrendt kein neues System, also keine staatliche Zulassung für Medizinprodukte.
"Wenn man es zu aufwändig macht, kann das eben auch dazu führen, dass bestimmte Produkte gar nicht mehr auf den Markt kommen, und dann ist den Patienten am wenigsten gedient."

Es beginnt damals, 2012, ein zähes Ringen um die neuen Regeln in der EU. Dagmar Roth-Behrendt ist die Berichterstatterin des Parlaments, also die führende Abgeordnete. Die Verbände der Industrie laufen Sturm gegen ihre Pläne: Es habe sich doch bewährt, das System mit den Prüfstellen, die das CE-Siegel erteilen. Innovative Produkte könnten so schneller Patienten helfen. Komme eine staatliche Zulassung, sei das das Ende der Medizinproduktebranche in der EU.
Der deutsche Verband BVMed schreibt auf Anfrage dazu, dass er es legitim findet, auf Fehlentwicklungen für eine Branche hinzuweisen, die für den Standort Deutschland wichtig sei.
"Da war die klare, einhellige Stoßrichtung: Wir wollen diese Gesetzgebung nicht, und wenn sie dann doch kommt, dann soll sie soweit aufgeweicht und ad absurdum geführt werden wie nur möglich. Das habe ich so bei keiner anderen Gesetzgebung erlebt."
Die Medizinproduktelobby hat in einem Punkt Recht: In Europa geht es schnell und einfach. So einfach, dass auch die großen US-Konzerne ihre Produkte oft lieber erstmal hier auf den Markt bringen, um Erkenntnisse zu sammeln.
"Wir müssen auch sehen, dass wir ja in anderen, nicht-europäischen Staaten Zulassungsvoraussetzungen haben, die höher sind als in Deutschland."
Hersteller nutzen lasche EU-Regeln
Professor Kurt Racké von der Uni-Klinik Bonn, Experte für Zulassungsstudien, weiß, wie die laschen Regeln in der EU von Herstellern genutzt werden.
"Das System funktioniert so, dass relativ schnell eine CE-Kennzeichnung erwirkt wird. Dann wird eine Beobachtungsstudie gerade auch in Deutschland etabliert, die Daten gesammelt werden, und diese Daten dann genutzt werden für die Zulassung bei in Amerika oder auch in Japan oder anderen Ländern."
"Dann sind die Europäer also die Versuchskaninchen?"
"Das kann man so überspitzt formulieren - und die deutschen Sozialsysteme sind die Bezahler."
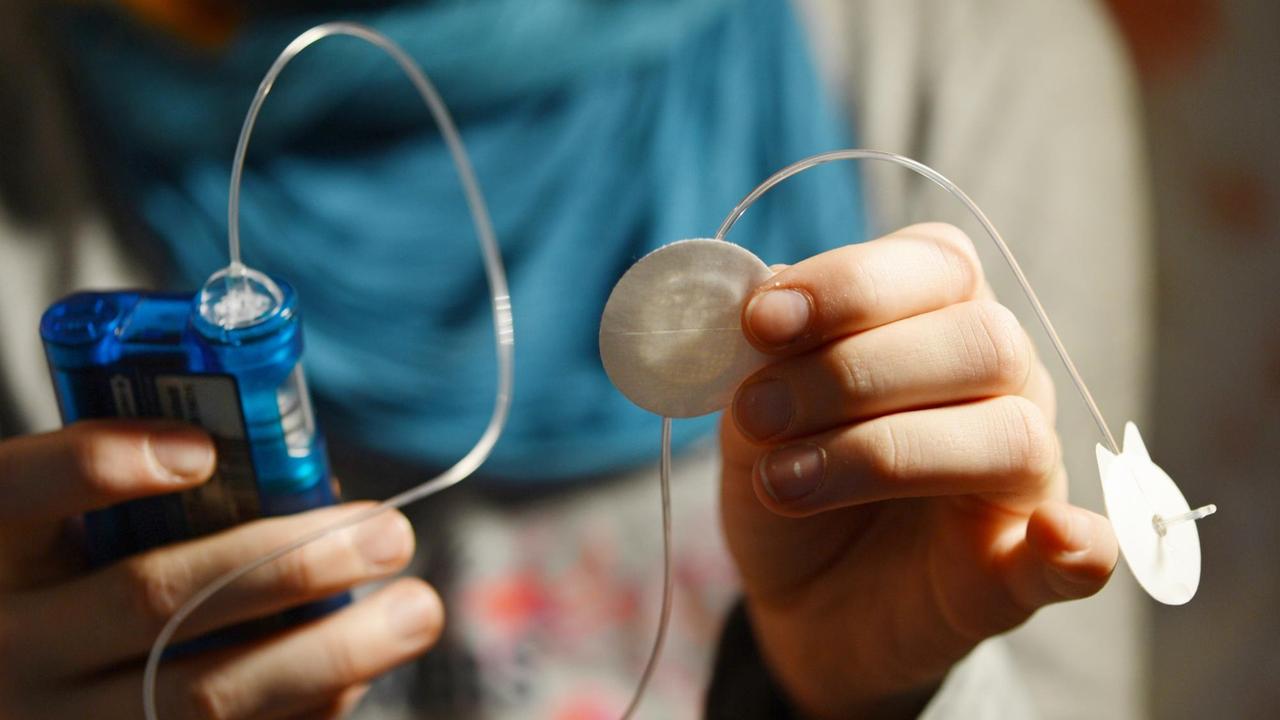
Der größte Medizinprodukte-Hersteller der Welt ist Medtronic. In Deutschland hat die Firma ihren Sitz in der Nähe von Düsseldorf. Weltweit arbeiten mehr als 85.000 Menschen für den Giganten aus den USA.
Medtronic ist auch Weltmarktführer bei Insulinpumpen: kleine, etwa faustgroße Computer, die das Insulin über einen Schlauch direkt in den Körper von Diabetes-Patienten abgeben. Das ist praktisch. Diabetiker können so einfacher die nötige Menge Insulin anpassen.
Das Gesetz erlaubt es Medtronic, neue Modelle der Pumpen nach dem Äquivalenzprinzip auf den Markt zu bringen. Dafür reicht es, wenn die Firma erklärt, dass sie einem älteren Modell ähnlich sind. Die internationalen Recherchen, an denen WDR, NDR und Süddeutsche Zeitung beteiligt sind, zeigen, dass auch andere Hersteller das so machen. Seit mehr als 40 Jahren kommen immer ausgefeiltere Modelle auf den Markt, ohne dass vorher neue klinische Studien gemacht werden mussten.
"Jeder Hersteller, der eine Produktänderung macht, wird dieses selbstverständlich als Produktverbesserung darstellen."
Jürgen Windeler vom IQwiG in Köln.
"Das entscheidende Problem ist, dass es natürlich damit gar nicht mehr äquivalent sein kann, weil der Hersteller selber behauptet ja, dass es eine Verbesserung ist, und diese Verbesserung kann natürlich dann, wenn es sehr schnell geht, diese Zyklen, mit Studien gar nicht mehr nachgehalten werden."
Deutschlands führender Kinder-Diabetologe und Medtronic
"Ich habe jetzt verschiedene Pumpen mitgebracht …"
Professor Thomas Danne aus Hannover ist der führende Kinder-Diabetologe in Deutschland. Er hat die Leitlinien für die Therapie mitgeschrieben, also die Empfehlungen, nach der sich seine Kollegen bei ihrer Arbeit richten sollen. Er schwört auf Insulinpumpen.
"Weil gerade in der Behandlung von kleinen Kindern Flexibilität extrem wichtig ist. In Deutschland ist es jetzt so, dass 91 Prozent aller Kinder unter sechs Jahren mit einer Insulinpumpe behandelt werden, bei uns 100 Prozent."

Professor Danne aus Hannover arbeitet eng mit Medtronic zusammen. Er hat Studien im Auftrag des Konzerns verfasst, Beraterhonorare bekommen, und in Medtronic-Pressemitteilen die Insulinpumpen des Konzerns gelobt. Danne betont, dass er auch mit anderen Herstellern zusammenarbeitet. Allerdings ist er auch an einer Firma in Israel beteiligt, die Software für Insulinpumpen entwickelt. Medtronic ist strategischer Partner dieser Firma. Und hat umgerechnet mehr als 1,7 Millionen Euro investiert.
"Das ist ja auch eine sinnvolle Geschichte, dass man das weiterentwickelt - und wie jeder Ingenieur sein intellektuelles Gut sozusagen schützt, denke ich, ist das auch bei Medizinern eigentlich eine Sache, die Gang und Gäbe ist. Aber das Wichtigste ist Transparenz."
"Also würden sie das auch offenlegen, wie viel sie jetzt von Medtronic da bekommen?"
"Selbstverständlich."
"Aber das wissen Sie jetzt nicht aus dem Kopf?"
"Das weiß ich aus dem Kopf nicht."
Per E-Mail teilt Professor Danne später mit, dass er sich zu Vertragsinhalten doch nicht äußern möchte.
Empfehlungen für die Ärzteschaft ohne Lobbyisten
"Das ist sicher die gröbste Geschichte, wenn jemand zu einem Produkt forscht, wo er selber dran verdient und darüber publiziert und noch Leitlinien dazu schreibt. Das geht nicht."
Thomas Lempert ist auch Arzt. Er hat die Organisation "Leitlinien-Watch" gegründet. Sie setzt sich dafür ein, dass die Empfehlungen für die Ärzteschaft von Kollegen geschrieben werden, die kein Geld von der Industrie bekommen. Wäre das die Regel, hätte Professor Danne die Leitlinie nicht mitschreiben dürfen.
"Genauso wie ich als Mitglied von Bayern München kein Bayern-Spiel in der Bundesliga pfeifen kann."
Knochen wie Schweizer Käse
"Weil ich ja Techniker bin, ist es für mich selbstverständlich, dass ich Dinge einbaue in Aggregate, in Maschinen, die halten. Beim Mensch ist das offensichtlich anders."
Jürgen Thoma aus der Nähe von Freiburg ist 61 und Chef-Techniker einer Winzerei. Qualität ist ihm wichtig. Deshalb entschied er sich für ein besonders angepriesenes Modell, als er vor 13 Jahren ein neues Hüftgelenk brauchte. Eine Weiterentwicklung der bekannten Firma Zimmer Biomet. Mit einem großen Metallkopf oben am Oberschenkelknochen, für mehr Beweglichkeit.
"Aktive 800-Meter-Läufer hätten die drin und Bergsteiger. Und dann war für mich klar, also ich brauche weder 800 Meter laufen noch bergsteigen - ich wollte einfach nur gut gehen können."
Knapp vier Jahre nach der OP wird klar: Die Prothese muss wieder raus. Sie hat Jürgen Thoma und hunderte andere Patienten geschädigt. Es gab Metallabrieb. Winzige Metallpartikel sind nach und nach von der Prothese in seinen Oberschenkel übergegangen. Der Knochen ist stark angegriffen.
"Das sieht aus, wie ein poröser Schwamm, wie Schweizer Käse. So wird der Knochen letztendlich aufgefressen mit allen möglichen Löchern, und der Knochen ist einfach nicht mehr da."
Länderbehörden für Implantationsstop zuständig
Ähnliche Prothesenmodelle anderer Hersteller haben auch Patienten durch Metallabrieb geschädigt und mussten teilweise zurückgerufen werden. Die Firma Zimmer Biomet durfte ihre Prothese erst einmal weiter verkaufen. Das für Medizinprodukte zuständige Bundesamt, das BfArM in Bonn, hatte sich zwar für einen Implantationsstop ausgesprochen. Doch es kann solche Maßnahmen nicht anordnen. Dafür sind in Deutschland die Länderbehörden zuständig, in diesem Fall das Regierungspräsidium Freiburg. Dort weigerte man sich 2010, einen Rückruf anzuordnen. 2012 hieß es dann auf Anfrage von Patienten, das Problem habe sich erledigt, die Prothese werden ja nicht mehr vertrieben.

Zimmer Biomet hatte den Verkauf der Prothese in der Zwischenzeit gestoppt - freiwillig. Auf Anfrage teilt die Firma mit, dass sie nach wie vor davon ausgehe, dass die Prothese nicht fehlerhaft sei. Das Regierungspräsidium Freiburg antwortet, dass es auch heute noch der Auffassung sei, dass nach damaligem Kenntnisstand die Voraussetzungen für die Anordnung eines Vertriebsstopps nicht gegeben waren.
"Ich bin überzeugt, dass wir als Patienten genau diese Konstruktion, dieses Design testen sollten. Wir waren die Versuchskaninchen, wir fühlen uns nicht nur so, wir waren sie."
"Die haben jetzt wieder einen Befangenheitsantrag gestellt ..."
Prozess um Entschädigung seit acht Jahren
Jürgen Thoma sitzt mit seinem Anwalt zusammen. Er hat Zimmer Biomet verklagt. Der Prozess läuft seit acht Jahren. In der ersten Instanz.
"Für die vielen älteren Mandanten, die ich habe, ist es eine sehr, sehr große Belastung. Es gibt welche, die sagen, vielleicht erlebe ich das gar nicht mehr, dass ich hier eine Entschädigungszahlung bekomme."
Die Gutachter im Prozess sind zu dem Ergebnis gekommen: Die Konstruktion der Prothese mit dem neuartigen großen Kopf konnte so nicht funktionieren. Und: Der Fehler im Design hätte erkannt werden können, wenn Zimmer Biomet die Prothese ausreichend getestet hätte.
"Es gibt ein nicht-behördliches System über benannte Stellen, die die Verantwortung für die Qualität des Produktes im Wesentlichen dem Unternehmen selber zuschreibt. Der Wunsch des europäischen Gesetzgebers war, möglichst viele Medizinprodukte auf den Markt zu bringen, möglichst innovativ zu sein."
Bundesgesundheitsministerium lehnt Interview ab
"Ich wollte ja eine Gesetzgebung machen, die für die Patienten mehr Sicherheit bietet, aber die Medizinprodukte-Hersteller trotzdem gut produzieren lässt."
Dagmar Roth-Behrendt, ehemalige Europaabgeordnete.
"Ich bin auch überzeugt, dass das geht. Aber das, was da auf dem Tisch liegt, das ist es nicht."
Als Dagmar Roth-Behrendt 2014 aus dem Europaparlament ausscheidet, sind die neuen Regeln für Medizinprodukte noch nicht fertig. Sie muss erleben, wie die Regierungen der EU-Länder ihre Vorschläge in den Verhandlungen weiter aufweichen, ganz besonders Deutschland. Das Bundesgesundheitsministerium hat ein Interview dazu abgelehnt.
2017 werden dann die neuen Regeln beschlossen. Es soll Verschärfungen geben, mehr Kontrollen, eine europaweite öffentliche Datenbank, und mehr klinische Tests, bevor ein Produkt auf den Markt darf. Aber: Ob eine Studie aussagekräftig ist, ob sie lang genug ist, um etwas über Nutzen oder Schaden für Patienten herauszufinden, bewerten auch in Zukunft private Prüfstellen wie der TÜV.
"Ich glaube, es ist ein guter Kompromiss."
Peter Liese, Europaabgeordneter der CDU.
"Wir haben in Deutschland nicht nur sehr viele Arbeitsplätze, wir haben eben auch viele Innovationen. Und eine Regulierung, die dazu führt, dass zwar hundertprozentige Sicherheit ist, aber nichts Neues mehr auf den Markt kommt, ist auch nicht im Sinne der Patienten."
"Das alte System der Bewertung hat gewonnen"
"Ich bedauere, dass bei der Umsetzung nicht wirklich für die Zulassung neue Kriterien geschaffen wurden, vergleichbar einer Zulassung eines Arzneimittels."
Professor Kurt Racke, Uniklinik Bonn.
"Das ist also sehr zu bedauern, dass im Endeffekt dann wieder das alte System der Bewertung im Markt gewonnen hat."
Mitte Oktober im Landgericht Freiburg. Nach acht Jahren Prozess hat Jürgen Thoma Recht bekommen. Laut Urteil hätte die Firma Zimmer Biomet das Risiko ernst nehmen müssen, dass es mit der Hüftprothese zu Metallabrieb kommen kann. Sie hätte sie umfangreicher testen müssen.
"Also besser konnt’s nicht laufen. Das Gericht hat eigentlich allem zugestimmt, was wir gefordert hatten."
Jürgen Thoma bekommt 25.000 Euro Schmerzensgeld zugesprochen. Allerdings ist dieses Urteil nicht rechtskräftig. Zimmer Biomet geht in Berufung. Die Firma sagt weiterhin, dass ihre Hüftprothese nicht fehlerhaft gewesen sei.