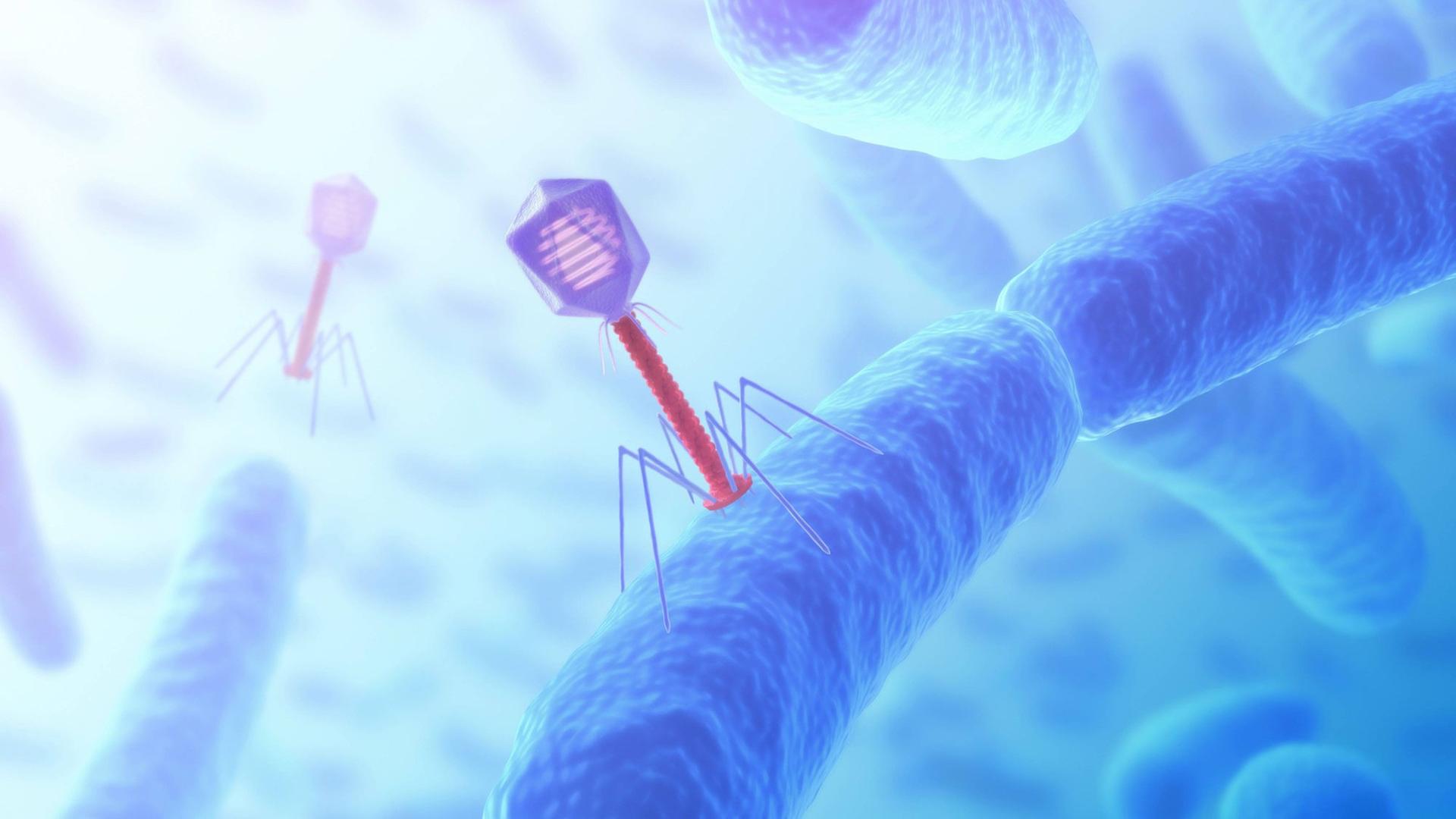
Das könnte heute wieder so ein richtiges Ekelthema werden. Heute bin ich unterwegs, um Phagen zu jagen. Bakteriophagen, Bakterienfresser. Und die findet man auch besonders gut dort, wo es viele Bakterien gibt, wie zum Beispiel in einer Kläranlage. Deshalb habe ich jetzt meine Gummistiefel eingepackt und bin unterwegs in Braunschweig, um eine Expertin zu Treffen für das Jagen nach Phagen. Es ist ein bisschen außerhalb, ich laufe jetzt auf ein großes Schild zu: Science Campus Braunschweig Süd. Und da scheine ich richtig zu sein. Ich hoffe nur, dass das Ganze heute nicht zu sehr stinken wird."
Mein Ziel in Braunschweig ist das Leibniz-Institut DSMZ. Im Jahr 1928 wurde das Penicillin entdeckt. In der Zeit davor waren die Mediziner keineswegs machtlos gegenüber bakteriellen Infektionen. Die alten Konzepte wurden jedoch weggefegt vom durchschlagenden Erfolg der Antibiotika. Mittlerweile sieht es etwas anders aus: Die Antibiotika wirken nicht mehr so gut wie einst, denn die Bakterien haben Resistenzen gegen sie entwickelt. Und so besinnt man sich wieder auf vermeintlich überkommene Therapien.
"Guten Tag, Sie sind Herr Reuning?" - "Ja, genau. Hallo." - "Christine Rohde. Herzlich Willkommen." - "Freut mich."
Winzig kleine Gebilde, die schon einmal große Hoffnungen weckten, sind Bakteriophagen. Und die lagern hier, in der Deutschen Sammlung von Mikroorganismen und Zellkulturen. Verabredet bin ich mit Dr. Christine Rohde.
"Ich weiß nicht, ich habe meine Gummistiefel mitgebracht. Werden wir die brauchen?" – "Also, ich habe keine. Ich hoffe, nicht."
Mein Ziel in Braunschweig ist das Leibniz-Institut DSMZ. Im Jahr 1928 wurde das Penicillin entdeckt. In der Zeit davor waren die Mediziner keineswegs machtlos gegenüber bakteriellen Infektionen. Die alten Konzepte wurden jedoch weggefegt vom durchschlagenden Erfolg der Antibiotika. Mittlerweile sieht es etwas anders aus: Die Antibiotika wirken nicht mehr so gut wie einst, denn die Bakterien haben Resistenzen gegen sie entwickelt. Und so besinnt man sich wieder auf vermeintlich überkommene Therapien.
"Guten Tag, Sie sind Herr Reuning?" - "Ja, genau. Hallo." - "Christine Rohde. Herzlich Willkommen." - "Freut mich."
Winzig kleine Gebilde, die schon einmal große Hoffnungen weckten, sind Bakteriophagen. Und die lagern hier, in der Deutschen Sammlung von Mikroorganismen und Zellkulturen. Verabredet bin ich mit Dr. Christine Rohde.
"Ich weiß nicht, ich habe meine Gummistiefel mitgebracht. Werden wir die brauchen?" – "Also, ich habe keine. Ich hoffe, nicht."
Bakteriophagen sind Viren. Viren, die nicht uns Menschen befallen, sondern Bakterien. Dazu verankern sie sich an der Oberfläche des Bakteriums und injizieren ihr eigenes Erbgut in die Zelle. Eine feindliche Übernahme, denn das Bakterium stellt nun in seinem Inneren die nächste Generation der Phagen her. So lange, bis es irgendwann platzt und einen Schwarm von Phagen ausstößt – die dann die nächsten Bakterien entern.
"Wir sind hier im Phagenlabor der DSMZ, und das sieht hier nach viel Arbeit aus. Es steht recht vollgestellt. Alles weil wir gerade dabei sind, Phagenproben aufzuarbeiten und auch neue Phagen aus Umweltproben zu isolieren", erzählt Dr. Christine Rohde.
Der Clou: die winzigen Enterhaken der Phagen sind hochspezifisch. Es gibt Phagen, die nur Staphylokokken befallen. Und solche, die es nur auf Pseudomonaden abgesehen haben. Oder auf Salmonellen. Oder auf Coli-Bakterien. Im Gegensatz zu Antibiotika schadet eine Behandlung mit Phagen nicht den nützlichen Bakterien.

Das Prinzip wäre perfekt, um die schwächelnden Antibiotika zu ergänzen. Aber man muss auch immer eine passende Phage in der Umwelt finden für jeden Keim. Genau das gehört zu den Aufgaben von Christine Rohde: Sie sucht. Und dazu braucht sie zunächst einmal ein Gerät, das aussieht wie ein Besenstiel.
"Das ist jetzt was?"
"Das ist ein professioneller Probennehmer. Wenn wir an die Kläranlage oder Teiche oder Flüsse gehen zum Wasserproben-Nehmen."
"Sieht erstmal aus wie irgendein Haushaltsgerät, ein Schrubber oder so was. Aber da kommt jetzt ein Becherglas vorne dran."
"Ja, wir haben hier so ein Becherglas. Das muss hier dran. Und dann können wir da aus den Tiefen schöpfen. Dann nehmen wir uns noch eine Flasche."
Und dann kann es losgehen. Zum Glück nicht in eine Kläranlage, denn gleich hinter dem DSMZ-Gebäude können wir auch fündig werden.
"Das ist jetzt was?"
"Das ist ein professioneller Probennehmer. Wenn wir an die Kläranlage oder Teiche oder Flüsse gehen zum Wasserproben-Nehmen."
"Sieht erstmal aus wie irgendein Haushaltsgerät, ein Schrubber oder so was. Aber da kommt jetzt ein Becherglas vorne dran."
"Ja, wir haben hier so ein Becherglas. Das muss hier dran. Und dann können wir da aus den Tiefen schöpfen. Dann nehmen wir uns noch eine Flasche."
Und dann kann es losgehen. Zum Glück nicht in eine Kläranlage, denn gleich hinter dem DSMZ-Gebäude können wir auch fündig werden.
"Wir schöpfen jetzt mal einen Liter Teichwasser!"
"Wir sind jetzt hier auf dem Institutsgelände an einem kleinen Tümpel. Der ist ein bisschen zugewachsen. Kommen wir da überhaupt ran?"
"Oh, der ist aber tatsächlich…"
Und dann die nächste Überraschung, als wir uns dem hölzernen Steg nähern, der in den Teich hineinragt.
"Oh, der ist gesperrt!"
"Aber man kommt da dran."
Ein Rot-weißes Absperrgitter blockiert den Zugang. Tja, aber was tut man nicht alles im Dienst der Wissenschaft? Also weg damit.
"Vielleicht ist einfach der Steg schon ein bisschen morsch. Ich hätte vielleicht doch die Gummistiefel."
Wir bahnen uns den Weg durch das Schilf und betreten die rutschige Plattform.
"So, wir schöpfen jetzt mal einen Liter Teichwasser in der Hoffnung, dass da ein paar nette neue Phagen drin sind. Das Wasser sieht relativ sauber aus, das hat aber nichts zu sagen. Kommt natürlich immer darauf an, welche Bakterien so in einem Gewässer sind. Und ehrlich gesagt vermute ich jetzt nicht zum Beispiel Staphylokokkus Aureus in großer Zahl. Daher werden wir hier keine Phagen finden so einfach gegen Staphylokokken."
"Ich hatte doch erwartet, dass wir jetzt irgendwie in eine Kläranlage gehen. Ist das so Ihr typischer Arbeitsplatz?"
"Ja, in die Kläranlagen in der Umgebung gehen wir so zirka einmal pro Monat. Aber selbst die Kläranlagen sind uns nicht genug. Wir gehen seit ein bis zwei Jahren schon in die klinischen Abwässer, ja. Weil da eben die Vielfalt der klinisch bedeutsamen Bakterien viel größer ist und auch die Wahrscheinlichkeit, passende Phagen zu bekommen."
Schon 1917 gab es ein Phagen-Präparat
Bei der Suche nach Alternativen zu den wirkungslos werdenden Antibiotika blicken Forschende nun auch zurück auf die Zeit vor der Entdeckung des Penicillins. Denn bereits damals gab es Therapien gegen bakterielle Infektionen. Die Phagen gehörten dazu.
1917 schon sollte ein Phagen-Präparat dabei helfen, Patienten mit Bakterienruhr zu heilen. Jetzt werden sie wiederentdeckt, sagt Christine Rohde. Aber warum hat man nicht bereits früher damit angefangen?
"Wir wurden eben sehr verwöhnt durch die Antibiotika. Und die Antibiotika können auch nicht oder bestimmt niemals durch Phagen wirklich ersetzt werden. Die Phagen werden Antibiotika ergänzen, aber nicht vollkommen ersetzen. Und das ist auch gar nicht unser Ziel. Also, man hat es einfach vergessen. Die Phagen sind in der Versenkung geblieben, weil die Antibiotika ja eigentlich ganz gut gewirkt haben. Meistens wirken sie ja zum Glück immer noch."
"Welche Medikamente gibt es denn bereits auf Basis von Bakteriophagen?"
"Welche Medikamente gibt es denn bereits auf Basis von Bakteriophagen?"
"Es ist so: Wir haben in Georgien die Situation, da ist Georgien wirklich ganz besonders zu nennen, da haben wir in zirka sechshundert Apotheken zugelassene, von der Georgischen Regierung zugelassene Apotheken-Präparate. Die kann jeder rezeptfrei kaufen. Und die Georgier machen auch heute noch patientenspezifische Präparate auf Anfrage oder bei besonderem individuellen Bedarf."
"Wie sieht es denn außerhalb von Georgien aus, hier zum Beispiel in Deutschland?"
"In Deutschland fangen wir eigentlich relativ neu an, obwohl in Deutschland Phagentherapie in ganz kleinem Maßstab gelaufen ist in einer Klinik in Hamburg bis 1984. Aber ansonsten ist in Deutschland fast gar keine Phagentherapie. Ich kann auch jetzt keine konkreten Beispiele nennen. Es gibt in seltenen Fällen Phagentherapie, aber es ist eben noch nicht zugelassen. Und wir müssen jetzt den Zulassungsweg mit der Zulassungsbehörde gemeinsam beschreiten und dann natürlich auch auf die europäische Ebene gehen, an die EMA."
"Phagen sind ja biologische Gebilde. Sie haben Erbmaterial. Erbmaterial kann verändert werden. Ist es denn überhaupt möglich, Phagen als Medikament zuzulassen, wenn man gar nicht weiß: Was passiert denn mit diesen, ich sag mal jetzt, Wirkstoffen?"
Keine gentechnisch veränderten Phagen einsetzen
"Ja, Phagen sind ein Biologikum oder werden zu den Biologika gezählt werden, das ist klar. Ein Phage kann auch mutieren, aber man sollte sich das nicht so vorstellen, dass die Phagen hin und her und kreuz und quer mutieren und sich selber ständig verändern. Und unsere Absicht ist ja ohnehin, auf gar keinen Fall gentechnisch veränderte Phagen in der nächsten Zukunft einzusetzen. Also das passt schon insofern. Und Angst ist da auch gar nicht begründet, weil wir die Phagen genomisch, das heißt in Hinblick auf ihr Erbmaterial, ständig prüfen. Und da können wir eben bioinformatisch jeden Phagen sehr genau angucken."
"Gibt es denn schon einen Kandidaten für ein Phagenmedikament in Deutschland?"
"Ja, im Moment entwickeln wir tatsächlich Phagenpräparate oder einen Cocktail, wir nennen das einen Phagencocktail, der zur Anwendung kommen soll bei CF-Patienten, Mukoviszidose, oder Bronchiektase-Patienten. Und zwar sollen die Phagen inhalativ verabreicht werden. Das ist eine Kooperation mit der Charité in Berlin und auch mit dem Fraunhofer Institut ITEM hier in Braunschweig bei uns in der Nähe. Wir sind also mitten drin. Und es soll eine klinische Studie im engen Sinn werden."
Phagen als Ergänzung zu konventionellen Antibiotika. Für das post-antibiotische Zeitalter holt man sich Inspiration in der prä-antibiotischen Ära. Und manche Forschenden gehen sogar noch einen Schritt weiter, wie etwa bei der Firma Lysando in Regensburg. Dort entwickelt man Inhaltsstoffe der Phagen weiter zu maßgeschneiderten antibakteriellen Wirkstoffen. Die Gummistiefel sind zu Hause geblieben. Die brauche ich nicht für einen harmlosen Laborbesuch.
"Zu Beginn muss ich Sie darauf hinweisen, dass wir hier mit humanpathogenen Bakterien arbeiten, die also auch für den Menschen prinzipiell gefährlich werden könnten"
"Oh je!"
"Soweit bei uns ist aber alles sauber. Sobald Sie also bei uns nichts anfassen et cetera, sind Sie eigentlich sicher. Und solange Sie gesund sind, stellt der Besuch bei uns jetzt auch keine Gefahr da."
"Okay, gesund bin ich. Hoffen wir mal, dass das auch so bleibt und schauen jetzt einfach mal im Labor vorbei."
"Gerne!"
Und dann reicht mir Martin Grießl einen weißen Kittel, der sich anfühlt, als bestünde er aus einem dünnen Vliesstoff. Ein Einwegkittel, der nach meinem Besuch im Labor entsorgt wird, erklärt sein Kollege Manfred Biebl.
"Der geht dann direkt in den kontaminierten Müll, wird autoklaviert und entsorgt. Okay, wir beginnen jetzt hier vorne mal mit dem mikrobiologischen Teil des Labors."
"Gibt es denn schon einen Kandidaten für ein Phagenmedikament in Deutschland?"
"Ja, im Moment entwickeln wir tatsächlich Phagenpräparate oder einen Cocktail, wir nennen das einen Phagencocktail, der zur Anwendung kommen soll bei CF-Patienten, Mukoviszidose, oder Bronchiektase-Patienten. Und zwar sollen die Phagen inhalativ verabreicht werden. Das ist eine Kooperation mit der Charité in Berlin und auch mit dem Fraunhofer Institut ITEM hier in Braunschweig bei uns in der Nähe. Wir sind also mitten drin. Und es soll eine klinische Studie im engen Sinn werden."
Phagen als Ergänzung zu konventionellen Antibiotika. Für das post-antibiotische Zeitalter holt man sich Inspiration in der prä-antibiotischen Ära. Und manche Forschenden gehen sogar noch einen Schritt weiter, wie etwa bei der Firma Lysando in Regensburg. Dort entwickelt man Inhaltsstoffe der Phagen weiter zu maßgeschneiderten antibakteriellen Wirkstoffen. Die Gummistiefel sind zu Hause geblieben. Die brauche ich nicht für einen harmlosen Laborbesuch.
"Zu Beginn muss ich Sie darauf hinweisen, dass wir hier mit humanpathogenen Bakterien arbeiten, die also auch für den Menschen prinzipiell gefährlich werden könnten"
"Oh je!"
"Soweit bei uns ist aber alles sauber. Sobald Sie also bei uns nichts anfassen et cetera, sind Sie eigentlich sicher. Und solange Sie gesund sind, stellt der Besuch bei uns jetzt auch keine Gefahr da."
"Okay, gesund bin ich. Hoffen wir mal, dass das auch so bleibt und schauen jetzt einfach mal im Labor vorbei."
"Gerne!"
Und dann reicht mir Martin Grießl einen weißen Kittel, der sich anfühlt, als bestünde er aus einem dünnen Vliesstoff. Ein Einwegkittel, der nach meinem Besuch im Labor entsorgt wird, erklärt sein Kollege Manfred Biebl.
"Der geht dann direkt in den kontaminierten Müll, wird autoklaviert und entsorgt. Okay, wir beginnen jetzt hier vorne mal mit dem mikrobiologischen Teil des Labors."
Wirkung von Artilysinen im Labor testen
Die beiden Wissenschaftler leiten bei der Regensburger Firma die Forschungs- und Entwicklungsabteilung. Sie beschäftigen sich nicht mit den Phagen selbst, sondern nutzen nur Werkzeuge der Viren: Jene Moleküle, welche die Zellwand der Bakterien so stark schwächen, dass die Einzeller unter ihrem eigenen Innendruck zerbersten. Die Biologin Eva Schirmeier führt im Labor vor, wie die Wirkung dieser Artilysine in einem Probengläschen im Labor aussehen kann.
"Vor uns sehen wir zwei Glasgefäße, in denen jeweils ein Milliliter einer trüben Flüssigkeit sind. Diese Flüssigkeit beinhaltet Bakterien der Gattung Streptokokkus. Die sind bekannt dadurch, dass die Karies verursachen oder Hals-Nasen-Ohren-Entzündungen. Diese Trübung der Flüssigkeit kommt daher, dass die Bakterien in einer sehr hohen Konzentration vorliegen. Also, es sind ein bis zehn Milliarden Bakterien in so einem Milliliter der Flüssigkeit. Im rechten Gefäß, da steht 'Puffer' drüber, da pipettiert die Frau Dr. Cornelissen eine Kontrolllösung rein ohne Artilysine. Und in das linke Gefäß, da steht Artilysin davor, pipettiert sie eine Lösung mit Artilysinen."
"Prima, es hat nicht gespritzt, wir sind sicher."
"Die rechte Lösung, die eben die Bakterien mit der Kontrollflüssigkeit enthält, die bleibt trübt. Das linke Gefäß mit der trüben Flüssigkeit und der Artilysinlösung klart jetzt nach und nach auf. Die Aufklarung kommt daher, dass die Artilysine die Zellwand der Bakterien zerstören und die Bakterien sozusagen platzen. Also kann man sich das vorstellen wie einen Luftballon oder einen Autoreifen, in den man mit einer spitzen Nadel oder mit einem scharfen Gegenstand reinsticht."
Das funktioniert sogar mit den gefährlichen gramnegativen Bakterien. Deren Zellwand ist besonders robust aufgebaut und bildet daher eine Barriere für konventionelle Antibiotika, die üblicherweise ins Innere der Zelle gelangen müssen. Verschärft wird die Situation dadurch, dass gerade unter diesen gramnegativen Keimen die Resistenzen in den vergangenen Jahren deutlich zugenommen haben. Mit Hilfe der Artilysine ließen auch sie sich wirksam bekämpfen.
"So, jetzt auf der rechten Seite sieht man immer noch eine Trübung. Die hat sich seit dem Anfang nicht verändert. Links die Lösung ist jetzt komplett klar, so dass man jetzt eben sagen kann: Diese ein bis zehn Milliarden Bakterien, eine immense Zahl, ist jetzt komplett abgetötet."
"Vor uns sehen wir zwei Glasgefäße, in denen jeweils ein Milliliter einer trüben Flüssigkeit sind. Diese Flüssigkeit beinhaltet Bakterien der Gattung Streptokokkus. Die sind bekannt dadurch, dass die Karies verursachen oder Hals-Nasen-Ohren-Entzündungen. Diese Trübung der Flüssigkeit kommt daher, dass die Bakterien in einer sehr hohen Konzentration vorliegen. Also, es sind ein bis zehn Milliarden Bakterien in so einem Milliliter der Flüssigkeit. Im rechten Gefäß, da steht 'Puffer' drüber, da pipettiert die Frau Dr. Cornelissen eine Kontrolllösung rein ohne Artilysine. Und in das linke Gefäß, da steht Artilysin davor, pipettiert sie eine Lösung mit Artilysinen."
"Prima, es hat nicht gespritzt, wir sind sicher."
"Die rechte Lösung, die eben die Bakterien mit der Kontrollflüssigkeit enthält, die bleibt trübt. Das linke Gefäß mit der trüben Flüssigkeit und der Artilysinlösung klart jetzt nach und nach auf. Die Aufklarung kommt daher, dass die Artilysine die Zellwand der Bakterien zerstören und die Bakterien sozusagen platzen. Also kann man sich das vorstellen wie einen Luftballon oder einen Autoreifen, in den man mit einer spitzen Nadel oder mit einem scharfen Gegenstand reinsticht."
Das funktioniert sogar mit den gefährlichen gramnegativen Bakterien. Deren Zellwand ist besonders robust aufgebaut und bildet daher eine Barriere für konventionelle Antibiotika, die üblicherweise ins Innere der Zelle gelangen müssen. Verschärft wird die Situation dadurch, dass gerade unter diesen gramnegativen Keimen die Resistenzen in den vergangenen Jahren deutlich zugenommen haben. Mit Hilfe der Artilysine ließen auch sie sich wirksam bekämpfen.
"So, jetzt auf der rechten Seite sieht man immer noch eine Trübung. Die hat sich seit dem Anfang nicht verändert. Links die Lösung ist jetzt komplett klar, so dass man jetzt eben sagen kann: Diese ein bis zehn Milliarden Bakterien, eine immense Zahl, ist jetzt komplett abgetötet."
Das Regensburger Unternehmen entwickelt nicht fertige Medikamente. Die Artilysine stellen eine Wirkstoff-Plattform dar. Jede Substanz muss auf die konkrete Anwendung der Kunden zugeschnitten werden, also zum Beispiel auf eine bestimmte Bakteriengruppe. Die modifizierten Phagenwerkzeuge sind auch keine Antibiotika am klassischen Sinn, sagt Markus Graf Matuschka von Greiffenclau, der Vorsitzende des Verwaltungsrats der Lysando AG.
"Unsere Technologie hat technisch das Antibiotika-Problem gelöst. Es ist so, Antibiotika an sich als Technologie sind schon über siebzig Jahre alt. Und der Entdecker der Antibiotika, Fleming, Sir Fleming, hat ja damals auch schon darauf hingewiesen in seiner Nobelpreisrede 1945, dass Resistenzen kommen werden. Es hat nur keiner zuhören wollen. Und dieses System ist ein mathematisches Modell. Sie haben mittlerweile so viele Resistenzen im prozentualen Ansatz, dass Sie davon nicht mehr wegkommen. Und es ist absurd, anzunehmen, dass Sie das Problem, das durch Antibiotika verursacht wird, mit Antibiotika lösen könnten. Das ist in sich selbst absurd."
"Unsere Technologie hat technisch das Antibiotika-Problem gelöst. Es ist so, Antibiotika an sich als Technologie sind schon über siebzig Jahre alt. Und der Entdecker der Antibiotika, Fleming, Sir Fleming, hat ja damals auch schon darauf hingewiesen in seiner Nobelpreisrede 1945, dass Resistenzen kommen werden. Es hat nur keiner zuhören wollen. Und dieses System ist ein mathematisches Modell. Sie haben mittlerweile so viele Resistenzen im prozentualen Ansatz, dass Sie davon nicht mehr wegkommen. Und es ist absurd, anzunehmen, dass Sie das Problem, das durch Antibiotika verursacht wird, mit Antibiotika lösen könnten. Das ist in sich selbst absurd."
Bislang gibt es keine Resistenzen gegen Artilysine
Die bekannten Antibiotika sabotieren oft den Stoffwechsel der Bakterien, indem sie in deren komplexe biochemische Maschinerie eingreifen. Dagegen haben die Bakterien Strategien entwickelt, Resistenzen: Sie bauen die Antibiotika mit Enzymen ab, spülen sie mit molekularen Pumpen aus der Zelle heraus oder bauen ihren Stoffwechsel um. Ein ständiger Wettlauf zwischen Mensch und Bakterie. Resistenzen gegen Artilysine hingegen haben die Lysando-Forscher noch nicht beobachtet.
"Wir haben nicht nur nichts beobachtet, sondern wir haben versucht, über dritte Parteien natürlich, Resistenz zu provozieren. Und bis heute ist es niemandem gelungen, auf ein Artilysin eine Resistenz zu provozieren. Es gibt keine Resistenzen gegen Artilysine bis heute. Das hat eine ganze Reihe von Gründen. Herausheben möchte ich einmal, dass die Bakterien keine Zeit haben, um Resistenzgene untereinander auszutauschen, weil Artilysin im Gegensatz zu Antibiotika im Bruchteil von Sekunden wirkt. Antibiotika brauchen mehrere Tage, weil sie sabotieren und nicht wie wir einfach abwracken."
"Wann erwarten Sie denn die ersten Produkte auf dem Markt mit diesem Wirkstoff darin oder mit dieser Wirkstoffklasse?"
"Die ersten Produkte erwarten wir ab Ende 19, Anfang 20 im Bereich Tieranwendungen, Tierpharmazeutik. Dann Zahnmedizin ist zum Beispiel ein Thema aufgrund der Selektivität, des Erhalts des Mikrobioms, des gesunden Mikrobioms. Und ein weiteres Thema ist die Wundpflege. Schwere, tiefe Wunden, an denen immer mehr Menschen leiden. Auch da wird ein Produkt mit Artilysin auf den Markt kommen."
Neben den Phagen und ihren Werkzeugen zur Zerstörung der Bakterienhülle enthüllt ein Blick in die Medizingeschichte aber auch noch andere Methoden, wie man krank machende Keime unschädlich machen kann. Und dabei muss man sie noch nicht einmal abtöten. Manchmal genügt es schon, ihnen ihre Waffen zu nehmen – so dass sie im menschlichen Körper keinen Schaden mehr anrichten können. Solch einen Ansatz hat die medizinische MODIFY-Studie verfolgt. Worum es dabei ging, möchte ich mir von einem Forscher erläutern lassen, der daran beteiligt war.
"Wir haben nicht nur nichts beobachtet, sondern wir haben versucht, über dritte Parteien natürlich, Resistenz zu provozieren. Und bis heute ist es niemandem gelungen, auf ein Artilysin eine Resistenz zu provozieren. Es gibt keine Resistenzen gegen Artilysine bis heute. Das hat eine ganze Reihe von Gründen. Herausheben möchte ich einmal, dass die Bakterien keine Zeit haben, um Resistenzgene untereinander auszutauschen, weil Artilysin im Gegensatz zu Antibiotika im Bruchteil von Sekunden wirkt. Antibiotika brauchen mehrere Tage, weil sie sabotieren und nicht wie wir einfach abwracken."
"Wann erwarten Sie denn die ersten Produkte auf dem Markt mit diesem Wirkstoff darin oder mit dieser Wirkstoffklasse?"
"Die ersten Produkte erwarten wir ab Ende 19, Anfang 20 im Bereich Tieranwendungen, Tierpharmazeutik. Dann Zahnmedizin ist zum Beispiel ein Thema aufgrund der Selektivität, des Erhalts des Mikrobioms, des gesunden Mikrobioms. Und ein weiteres Thema ist die Wundpflege. Schwere, tiefe Wunden, an denen immer mehr Menschen leiden. Auch da wird ein Produkt mit Artilysin auf den Markt kommen."
Neben den Phagen und ihren Werkzeugen zur Zerstörung der Bakterienhülle enthüllt ein Blick in die Medizingeschichte aber auch noch andere Methoden, wie man krank machende Keime unschädlich machen kann. Und dabei muss man sie noch nicht einmal abtöten. Manchmal genügt es schon, ihnen ihre Waffen zu nehmen – so dass sie im menschlichen Körper keinen Schaden mehr anrichten können. Solch einen Ansatz hat die medizinische MODIFY-Studie verfolgt. Worum es dabei ging, möchte ich mir von einem Forscher erläutern lassen, der daran beteiligt war.
Oliver Cornely ist Professor am Universitätsklinikum Köln und Zentrum für Klinische Studien. In der MODIFY-Studie hat er sich mit dem Krankenhauskeim Clostridium difficile beschäftigt. Und diffizil ist der Umgang mit diesem Einzeller tatsächlich. Denn das Bakterium kann schweren Durchfall auslösen. Üblicherweise passiert das bei Patienten, die mit Antibiotika behandelt werden.
Der Krankenhauskeim Clostridium difficile ist gefährlich
"Das Bakterium ist gegen die meisten Antibiotika, die wir zur Therapie von Infektionen einsetzen, resistent. Und deshalb bleibt es quasi in höherer Zahl übrig, wenn man ein Antibiotikum einnimmt. Und dann werden alle empfindlichen Bakterien gestört, in der Anzahl reduziert, abgetötet. Und die resistenten, die bleiben übrig. Und das Clostridium difficile, das durchaus ein normaler Bewohner des Darms ist, gewinnt auf einmal an Bedeutung, die es vorher gar nicht hatte. Und Clostridium kann Toxine herstellen, Gifte herstellen. In der Situation, wenn man dann so ein Toxin bildendes Clostridium difficle in sich trägt, dann gewinnt das Oberhand. Und das Toxin stört dann und zerstört dann die Epithelschicht des Darms."
Bei manchen Patienten hilft es, das Antibiotikum abzusetzen. Andere hingegen entwickeln einen ausgeprägten Durchfall.
"Das können zwanzig bis dreißig Stuhlgänge pro Tag sein. Und da kann man sich ja gut vorstellen, dass wenn man davon betroffen ist, dann kann man's auch gar nicht mehr richtig zählen. Das ist fast so ein Kontinuum, wo man quasi auf der Toilette sitzen bleibt. Die sind schon sehr krank, die verlieren sehr viel Wasser. Man muss oft bei diesen Patienten auch Flüssigkeit geben, weil die gar nicht mehr so viel trinken können wie das aus dem Darm verloren geht."
Und wenn die Ärzte die Infektion in den Griff bekommen haben, muss das noch lange nicht heißen, dass sie auch tatsächlich besiegt ist. Denn mindestens ein Viertel der Betroffenen erlebt einen Rückfall. Das Problem sind dabei nicht einmal die Bakterien selbst, sondern das Toxin, also der Giftstoff, den sie herstellen.
"Wenn man das Toxin hindern würde, die Zellen anzugreifen, dann hätte man immer noch Clostridium difficile im Darm und auch das Toxin im Darm. Man würde es gar nicht merken, es würde einem nichts tun."
Und genau das war der Ausgangspunkt der MODIFY-Studie. Die Patienten mit einer Clostridien-Infektion erhielten künstlich hergestellte, maßgeschneiderte Antikörper, die das Toxin binden und neutralisieren. Und weil Clostridium difficile zwei verschiedene Toxine bildet, nämlich A und B, wurden auch zwei verschiedene Antikörper, zwei verschiedene Anti-Toxine verabreicht.
Bei manchen Patienten hilft es, das Antibiotikum abzusetzen. Andere hingegen entwickeln einen ausgeprägten Durchfall.
"Das können zwanzig bis dreißig Stuhlgänge pro Tag sein. Und da kann man sich ja gut vorstellen, dass wenn man davon betroffen ist, dann kann man's auch gar nicht mehr richtig zählen. Das ist fast so ein Kontinuum, wo man quasi auf der Toilette sitzen bleibt. Die sind schon sehr krank, die verlieren sehr viel Wasser. Man muss oft bei diesen Patienten auch Flüssigkeit geben, weil die gar nicht mehr so viel trinken können wie das aus dem Darm verloren geht."
Und wenn die Ärzte die Infektion in den Griff bekommen haben, muss das noch lange nicht heißen, dass sie auch tatsächlich besiegt ist. Denn mindestens ein Viertel der Betroffenen erlebt einen Rückfall. Das Problem sind dabei nicht einmal die Bakterien selbst, sondern das Toxin, also der Giftstoff, den sie herstellen.
"Wenn man das Toxin hindern würde, die Zellen anzugreifen, dann hätte man immer noch Clostridium difficile im Darm und auch das Toxin im Darm. Man würde es gar nicht merken, es würde einem nichts tun."
Und genau das war der Ausgangspunkt der MODIFY-Studie. Die Patienten mit einer Clostridien-Infektion erhielten künstlich hergestellte, maßgeschneiderte Antikörper, die das Toxin binden und neutralisieren. Und weil Clostridium difficile zwei verschiedene Toxine bildet, nämlich A und B, wurden auch zwei verschiedene Antikörper, zwei verschiedene Anti-Toxine verabreicht.
Eine Therapie gegen den Krankenhauskeim ist gefunden
"Das Ergebnis ist ein bisschen überraschend gewesen insofern, als dass wir bei dem Anti-Toxin A gar keinen Effekt gesehen haben. Dieser Arm in der Studie, Anti-Toxin A, ist dann auch geschlossen worden auf halber Strecke. In der Literatur findet man, dass das das besonders wichtige Anti-Toxin sein würde. Das können wir jetzt leider nicht mehr bestätigen. Aber wir hatten ja noch das Anti-Toxin B, und das war ein voller Erfolg und hat eine deutliche Reduktion in der Rate an wiederauftretendem Durchfall, also einen deutlichen vorbeugenden Effekt gehabt."
Vom medizinischen Standpunkt aus funktioniert die Behandlung. Zu klären sind nun noch die finanziellen Aspekte.
Vom medizinischen Standpunkt aus funktioniert die Behandlung. Zu klären sind nun noch die finanziellen Aspekte.
"Der Antikörper ist zugelassen. Der wird ja infundiert, das ist eine Infusion, einmalig. Und es gibt noch keinen festen Preis für den Antikörper. Der wird gerade noch verhandelt, sage ich mal, zwischen dem gemeinsamen Bundesausschuss und den zuständigen Behörden und dem Hersteller des Antikörpers."
Die Antikörper nehmen den Bakterien ihre Waffen, sie töten die Keime aber nicht. Daher rührt die Hoffnung, dass die Einzeller nicht so schnell Resistenzen entwickeln. Außerdem wirken auch die Antikörper hochspezifisch, ohne die nützlichen Bakterien im Darm in Mitleidenschaft zu ziehen. Ein Konzept, das sich zwar nicht auf alle, aber zumindest einige Krankenhauskeime übertragen lässt.
"Ja, es gibt Erreger, die ebenfalls Bakterien sind und Durchfälle verursachen. Und zum Beispiel die Shigellen kann man da nennen und andere Toxinbildner. Und da wären Antikörper durchaus auch eine Möglichkeit."
Die Idee, Antikörper gegen Bakterientoxine zu verabreichen, geht auf den Immunologen Emil von Behring und seinen japanischen Kollegen Kitasato Shibasaburō in den 1880er Jahren zurück. Sie hatten die sogenannte Serumtherapie entwickelt. Dabei injizierten sie nicht-tödliche Dosen von Diphterie- und Tetanus-Toxinen in Tiere. Deren Immunsystem bildete die Antikörper, die von den beiden Forschern isoliert und menschlichen Patienten verabreicht wurden. Im Jahr 1901 erhielt Emil von Behring dafür den Medizin-Nobelpreis, den allerersten, der je verliehen wurde.
"Die Serumtherapie, das sind wirklich die Anfänge aus dem letzten, oder es reicht die Idee schon fast ins vorletzte Jahrhundert zurück. Aber auf dessen Spuren wandeln wir damit, also hätte er damit nicht angefangen, dann wären wir vielleicht heute auch nicht so weit. Aber so ist das immer, dass man auf dem aufbaut, was die Generationen vorher an Wissen errungen haben. Im Englischen sagt man dann, man steht auf deren Schultern. Das ist eigentlich ein ganz schönes Bild, standing on their shoulders, weil man von dort also weiter sieht und mehr weiß, aber eben dadurch, dass man von den Vorherigen getragen wird."
Mit Hilfe der Antikörper entwaffnen die Mediziner die Bakterien, ohne sie zu töten. In der Hoffnung, dass die Keime so weniger Resistenzen gegen diese Art der Therapie entwickeln – denn der evolutionäre Druck wäre nicht groß genug. Emil von Behrings Serumtherapie reiht sich damit ein in moderne Forschungsansätze, die man als Anti-Virulenz-Strategie bezeichnet. Das Bakterium bleibt dabei am Leben, aber es macht niemanden mehr krank: Weil es keine Toxine mehr produziert, nicht mehr an Körperzellen andockt und auch keine hartnäckigen Kolonien mehr bildet.
Die Antikörper nehmen den Bakterien ihre Waffen, sie töten die Keime aber nicht. Daher rührt die Hoffnung, dass die Einzeller nicht so schnell Resistenzen entwickeln. Außerdem wirken auch die Antikörper hochspezifisch, ohne die nützlichen Bakterien im Darm in Mitleidenschaft zu ziehen. Ein Konzept, das sich zwar nicht auf alle, aber zumindest einige Krankenhauskeime übertragen lässt.
"Ja, es gibt Erreger, die ebenfalls Bakterien sind und Durchfälle verursachen. Und zum Beispiel die Shigellen kann man da nennen und andere Toxinbildner. Und da wären Antikörper durchaus auch eine Möglichkeit."
Die Idee, Antikörper gegen Bakterientoxine zu verabreichen, geht auf den Immunologen Emil von Behring und seinen japanischen Kollegen Kitasato Shibasaburō in den 1880er Jahren zurück. Sie hatten die sogenannte Serumtherapie entwickelt. Dabei injizierten sie nicht-tödliche Dosen von Diphterie- und Tetanus-Toxinen in Tiere. Deren Immunsystem bildete die Antikörper, die von den beiden Forschern isoliert und menschlichen Patienten verabreicht wurden. Im Jahr 1901 erhielt Emil von Behring dafür den Medizin-Nobelpreis, den allerersten, der je verliehen wurde.
"Die Serumtherapie, das sind wirklich die Anfänge aus dem letzten, oder es reicht die Idee schon fast ins vorletzte Jahrhundert zurück. Aber auf dessen Spuren wandeln wir damit, also hätte er damit nicht angefangen, dann wären wir vielleicht heute auch nicht so weit. Aber so ist das immer, dass man auf dem aufbaut, was die Generationen vorher an Wissen errungen haben. Im Englischen sagt man dann, man steht auf deren Schultern. Das ist eigentlich ein ganz schönes Bild, standing on their shoulders, weil man von dort also weiter sieht und mehr weiß, aber eben dadurch, dass man von den Vorherigen getragen wird."
Mit Hilfe der Antikörper entwaffnen die Mediziner die Bakterien, ohne sie zu töten. In der Hoffnung, dass die Keime so weniger Resistenzen gegen diese Art der Therapie entwickeln – denn der evolutionäre Druck wäre nicht groß genug. Emil von Behrings Serumtherapie reiht sich damit ein in moderne Forschungsansätze, die man als Anti-Virulenz-Strategie bezeichnet. Das Bakterium bleibt dabei am Leben, aber es macht niemanden mehr krank: Weil es keine Toxine mehr produziert, nicht mehr an Körperzellen andockt und auch keine hartnäckigen Kolonien mehr bildet.
Auch der Keim Acinetobacter Baumannii ist schwer zu behandeln
"Fünf Milliliter einer braunen Lösung. Das ist das Zeug, was die Bakterien fressen. Da ist nur das Beste drin, das ist wie Schoko für den Menschen. Das Bakterium freut sich, wächst und gedeiht. Und dann können wir das Bakterium, nachdem es gewachsen ist, untersuchen", berichtet Volker Müller.
Um Schwachstellen bei einem Bakterium zu finden, muss man den Feind, gut kennen. Das ist das Ziel eines großen DFG-Projektes zu einem Keim namens Acinetobacter baumannii. Daran beteiligt sind Forscher der Goethe-Universität Frankfurt: Volker Müller und Beate Averhoff.
"Und auf dieser Gelatine hier sehen wir einzelne Pünktchen. Und jedes Pünktchen sind Millionen von Bakterien, die durch konstante Zellteilung entstanden sind."
"Ich glaube, so was Ähnliches habe ich schon mal bei mir im Kühlschrank gesehen."
"Ja, das könnte gut sein. Häufig sieht man dann aber auch etwas, was so etwas schleimiger aussieht und so pilzartig wächst. Ja, gerade bei den Temperaturen, die wir gerade haben, muss man verdammt aufpassen."
Acinetobacter baumannii gehört zu den Krankenhauskeimen. Bekannt geworden ist das Bakterium als Iraki-bacter, weil er oft in infizierten Wunden von US-Soldaten zu finden war, die im Irak oder Afghanistan im Einsatz waren. Die Zahl der gegen ihn wirksamen Antibiotika schwindet zusehends. Der Keim hat eine steile Karriere hingelegt, sagt Volker Müller.
Um Schwachstellen bei einem Bakterium zu finden, muss man den Feind, gut kennen. Das ist das Ziel eines großen DFG-Projektes zu einem Keim namens Acinetobacter baumannii. Daran beteiligt sind Forscher der Goethe-Universität Frankfurt: Volker Müller und Beate Averhoff.
"Und auf dieser Gelatine hier sehen wir einzelne Pünktchen. Und jedes Pünktchen sind Millionen von Bakterien, die durch konstante Zellteilung entstanden sind."
"Ich glaube, so was Ähnliches habe ich schon mal bei mir im Kühlschrank gesehen."
"Ja, das könnte gut sein. Häufig sieht man dann aber auch etwas, was so etwas schleimiger aussieht und so pilzartig wächst. Ja, gerade bei den Temperaturen, die wir gerade haben, muss man verdammt aufpassen."
Acinetobacter baumannii gehört zu den Krankenhauskeimen. Bekannt geworden ist das Bakterium als Iraki-bacter, weil er oft in infizierten Wunden von US-Soldaten zu finden war, die im Irak oder Afghanistan im Einsatz waren. Die Zahl der gegen ihn wirksamen Antibiotika schwindet zusehends. Der Keim hat eine steile Karriere hingelegt, sagt Volker Müller.
"Acinetobacter baumannii ist sozusagen ein Newcomer auf dem Markt. Das Bakterium gibt es natürlich schon lange in der Umwelt, aber es wird erst in den letzten Jahren zunehmend in Krankenhäusern und dort insbesondere auf Isolierstationen gefunden und kann schon für verheerende Ausbrüche sorgen."
Die Mortalitätsrate bei diesem Bakterium ist relativ hoch.
"Aber man muss da jetzt keine Angst haben vor einem Krankenhausbesuch. Das Bakterium kommt gemeinhin nur vor auf Isolierstationen und ist ein sogenanntes opportunistisch pathogenes Bakterium, befällt also nur Patienten, die eh schon immungeschwächt sind. Normal gesunden Menschen kann dieses Bakterium nichts anhaben. Es ist sozusagen ein fieser Mob, der sich auf schon richtig kranke Menschen draufsetzt und dann auf diesem kranken Menschen wächst."
Die Mortalitätsrate bei diesem Bakterium ist relativ hoch.
"Aber man muss da jetzt keine Angst haben vor einem Krankenhausbesuch. Das Bakterium kommt gemeinhin nur vor auf Isolierstationen und ist ein sogenanntes opportunistisch pathogenes Bakterium, befällt also nur Patienten, die eh schon immungeschwächt sind. Normal gesunden Menschen kann dieses Bakterium nichts anhaben. Es ist sozusagen ein fieser Mob, der sich auf schon richtig kranke Menschen draufsetzt und dann auf diesem kranken Menschen wächst."
Auf der Suche nach Waffen gegen hartnäckigen Bakterien
Volker Müller erkundet derzeit den Lebensstil dieser hartnäckigen Bakterien: Was fressen sie, wie bewegen sie sich, wie haften sie an Oberflächen? Keine andere Arbeitsgruppe weltweit sucht in diesem Umfang nach Anti-Infektiva. Denn darin besteht das Ziel: Die Einzeller zu verstehen, um ihre Schwachstellen zu identifizieren.
"Ja, das hilft, neue Wirkstoffe zu finden, weil man dann sozusagen einen gradlinigen Weg geht. Bei der klassischen Suche macht man ein Screening auf Komponenten, der ist also sozusagen mehr oder weniger zufällig. Man sucht zufällig nach Komponenten, die das Wachstum der Bakterien hemmen."
"Also, wenn wir uns eine Infektion mit Acinetobacter baumannii auf einer Intensivstation anschauen, dann ist der häufigste Weg, dass es eine Infektion gibt über die künstlichen Beatmungsschläuche. Da wächst der Acinetobacter baumannii quasi drauf entlang, gelangt dann in unsere Lunge. Und die häufigsten Infektionen sind dann Pneumonien."
Beate Averhoff ist Professorin an der Goethe-Universität Frankfurt. Ihre Arbeitsgruppe stellte fest, dass das Bakterium sich von Fetten ernährt. Und diese Fette durch bestimmte Biokatalysatoren spaltet.
"Und in dieser Lungenmukosa, da findet Acinetobacter baumannii einen gedeckten Tisch, da haben wir sehr viele verschiedene Fette. Eines dieser Fette ist das sogenannte Phosphatidylcholin. Nun, das ist wie eine Götterspeise für Acinetobacter baumannii. Die zerlegt er. Dadurch wächst er. Er vermehrt sich rasant und kann dann weiter sich ausbreiten auch über die Blutbahn. Und Acinetobacter baumannii produziert für die Spaltung dieser Götterspeise eben diese Biokatalysatoren."
Wer diese Biokatalysatoren genau kennt, kann die Bakterien über diesen Angriffspunkt bekämpfen – und ihnen so ihre Hauptenergiequelle entziehen.
Der Forscherin geht es darum, die Marschverpflegung zu vernichten, oder die Einzeller zu entwaffnen.
"Ja, durchaus. Unser Ziel ist, die Waffen zu identifizieren. Und das muss man sagen: Acinetobacter baumannii hat ein Arsenal von Waffen. Es ist nicht so wie zum Beispiel bei den Cholera-Erregern, Vibrio Cholera, dass da ganz bestimmte Toxine, also Gifte, produziert werden, sondern Acinetobacter baumannii hat ein ganzes Arsenal verschiedener Waffen. Und wir haben uns zum Ziel gesetzt, wirklich die einzelnen Waffen zu identifizieren und dann vielleicht auch eine Kombination von Wirkstoffen gegen diese Waffen einzusetzen."
Bakteriophagen, Artilysine, Anti-Toxine und andere Antivirulenz-Therapien. Sie alle haben ihre Wurzeln in der Zeit vor der Entdeckung des Penicillins. Und könnten doch in ein paar Jahren einen wertvollen Beitrag leisten im zukünftigen Kampf gegen resistente Keime, indem sie die Palette der etablierten Medikamente ergänzen. Sie wirken oft nur gegen bestimmte Bakterien. Doch gleichzeitig ist ihre Selektivität auch ihr großer Vorteil: Denn nützliche Bakterien bleiben so am Leben. Antibiotika, gerade Breitband-Antibiotika, wirken wie ein Vorschlaghammer. Diese neuen alten Ansätze jedoch wie ein Skalpell. Sie arbeiten zielgerichtet und minimieren die Nebenwirkungen. Und können daher in manchen Fällen sogar die bessere Alternative zu Antibiotika sein.
Volker Müller erkundet derzeit den Lebensstil dieser hartnäckigen Bakterien: Was fressen sie, wie bewegen sie sich, wie haften sie an Oberflächen? Keine andere Arbeitsgruppe weltweit sucht in diesem Umfang nach Anti-Infektiva. Denn darin besteht das Ziel: Die Einzeller zu verstehen, um ihre Schwachstellen zu identifizieren.
"Ja, das hilft, neue Wirkstoffe zu finden, weil man dann sozusagen einen gradlinigen Weg geht. Bei der klassischen Suche macht man ein Screening auf Komponenten, der ist also sozusagen mehr oder weniger zufällig. Man sucht zufällig nach Komponenten, die das Wachstum der Bakterien hemmen."
"Also, wenn wir uns eine Infektion mit Acinetobacter baumannii auf einer Intensivstation anschauen, dann ist der häufigste Weg, dass es eine Infektion gibt über die künstlichen Beatmungsschläuche. Da wächst der Acinetobacter baumannii quasi drauf entlang, gelangt dann in unsere Lunge. Und die häufigsten Infektionen sind dann Pneumonien."
Beate Averhoff ist Professorin an der Goethe-Universität Frankfurt. Ihre Arbeitsgruppe stellte fest, dass das Bakterium sich von Fetten ernährt. Und diese Fette durch bestimmte Biokatalysatoren spaltet.
"Und in dieser Lungenmukosa, da findet Acinetobacter baumannii einen gedeckten Tisch, da haben wir sehr viele verschiedene Fette. Eines dieser Fette ist das sogenannte Phosphatidylcholin. Nun, das ist wie eine Götterspeise für Acinetobacter baumannii. Die zerlegt er. Dadurch wächst er. Er vermehrt sich rasant und kann dann weiter sich ausbreiten auch über die Blutbahn. Und Acinetobacter baumannii produziert für die Spaltung dieser Götterspeise eben diese Biokatalysatoren."
Wer diese Biokatalysatoren genau kennt, kann die Bakterien über diesen Angriffspunkt bekämpfen – und ihnen so ihre Hauptenergiequelle entziehen.
Der Forscherin geht es darum, die Marschverpflegung zu vernichten, oder die Einzeller zu entwaffnen.
"Ja, durchaus. Unser Ziel ist, die Waffen zu identifizieren. Und das muss man sagen: Acinetobacter baumannii hat ein Arsenal von Waffen. Es ist nicht so wie zum Beispiel bei den Cholera-Erregern, Vibrio Cholera, dass da ganz bestimmte Toxine, also Gifte, produziert werden, sondern Acinetobacter baumannii hat ein ganzes Arsenal verschiedener Waffen. Und wir haben uns zum Ziel gesetzt, wirklich die einzelnen Waffen zu identifizieren und dann vielleicht auch eine Kombination von Wirkstoffen gegen diese Waffen einzusetzen."
Bakteriophagen, Artilysine, Anti-Toxine und andere Antivirulenz-Therapien. Sie alle haben ihre Wurzeln in der Zeit vor der Entdeckung des Penicillins. Und könnten doch in ein paar Jahren einen wertvollen Beitrag leisten im zukünftigen Kampf gegen resistente Keime, indem sie die Palette der etablierten Medikamente ergänzen. Sie wirken oft nur gegen bestimmte Bakterien. Doch gleichzeitig ist ihre Selektivität auch ihr großer Vorteil: Denn nützliche Bakterien bleiben so am Leben. Antibiotika, gerade Breitband-Antibiotika, wirken wie ein Vorschlaghammer. Diese neuen alten Ansätze jedoch wie ein Skalpell. Sie arbeiten zielgerichtet und minimieren die Nebenwirkungen. Und können daher in manchen Fällen sogar die bessere Alternative zu Antibiotika sein.