Durch den menschlichen Körper zieht sich ein einmaliges Transportsystem: Allein 600 Liter Sauerstoff pro Tag werden hier befördert. Dazu Kraftstoff, Baumaterial, Abwehrzellen.
Die Gefäße sind auch Entsorgungsweg. Irgendwo gehen immer Zellen zugrunde. Ihre Hülle wird löchrig, der Inhalt ergießt sich und gelangt ins Blut: Zellbruchstücke, Eiweiße, auch das Erbgut der Zelle - die DNA.
"Bitte einmal eine Faust machen. Ich straffe die Haut jetzt ein bisschen und dann gibt es jetzt mal einen kleinen Pieks."
Man könnte die DNA im Blut abfangen. Aus ihrer Sequenz Krankheiten auslesen. Vor allem Krebs.
Jochen Vollmann, Arzt und Medizinethiker: "Flüssigbiopsie - sagt ja schon der Name: Es werden in der Blutbahn DNA-Fragmente zur genetischen Information gewonnen. Man hat also die große Chance, Informationen zu bekommen, ohne den Patienten belasten zu müssen."
Irgendwo am Rand dieses Transportsystems teilt sich eine Zelle ungezügelt. Eine Wucherung die noch lange nicht stört - aber wächst.
Blutgefäße bahnen sich auch hier einen Weg. Versorgen den keimenden Tumor mit allem was er braucht, und entsorgen den Müll. Auch Bruchstücke von mutierter DNA aus dem Tumor werden weggeschwemmt.
Edgar Dahl, Molekularpathologe: "Wenn Sie so eine Mutation im Blut sicher nachweisen würden, würden Sie aber immer noch nicht wissen: Welchen Tumor hat der Patient denn nun? Ist es ein Mammakarzinom, ein Dickdarmkarzinom oder ein Lungenkarzinom? Die Frage ist dann natürlich auch: Was fängt man mit so einem potentiellen Patienten an?"
Liquid Biopsy: Ihr größter Vorteil ist gleichzeitig ihr größter Schwachpunkt
Eine einfache Blutabnahme statt Abtasten, Ultraschall, Röntgenbilder. Ein kleiner Pieks statt einer unangenehmen Entnahme von verdächtigem Gewebe mittels Biopsie. Eine Revolution. Denn der Krebs, der im Verborgenen entsteht, unbemerkt wuchert, oft erst entdeckt wird, wenn die Chance auf Heilung schon fraglich ist - dieser Krebs wird nun im Blut erkennbar, möglicherweise von Anfang an. Eine Blutprobe belastet kaum: Man kann engmaschig testen. Ist das der Durchbruch?
Klaus Pantel, Krebsforscher: "Wir müssen definitiv die Tumoren entdecken, die wir, wenn wir sie frühzeitig entdecken, a) heilen können und die b) natürlich auch so aggressiv sind, dass wir dann durch diese frühzeitige Operation Leben retten. Darin liegt natürlich die ganz große Hoffnung der Liquid Biopsy."
Die Liquid Biopsy erobert gerade die Krebsmedizin. Erste Tests, die auf Blutproben basieren, werden bereits vermarktet.
Doch es gibt auch Risiken. Das neue Werkzeug ist nämlich so potent, dass es selbst kleinste Spuren aus dem Ruder gelaufener DNA erkennt, von denen der Patient besser nichts geahnt hätte.
Zum Beispiel, weil der Tumor von Anfang an unheilbar ist. Oder so harmlos, dass der Körper selbst mit ihm fertig werden kann. Der große Vorteil der Liquid Biopsy ist gleichzeitig ihr größter Schwachpunkt: Ihre Empfindlichkeit. Jochen Vollmann:
"Das Hauptproblem ist, dass sie eine Vielzahl von DNA-Fragmenten bestimmen können, aber nicht sicher sagen können, wofür sie stehen."
Ist der Krebs tödlich oder nicht? Aggressiv oder gutmütig? Lungen- oder Leberkrebs? Krebsforschern und Ärzten ist bewusst, dass sie den Umgang mit der Liquid Biopsy noch lernen müssen. Aber wo den Anfang machen? Wie das riesige Versprechen - eine Krebsdiagnose aus ein paar Millilitern Blut - so einlösen, dass sie Patienten hilft - und nicht schadet?
"Aus einem großen Heuhaufen das einzige grüne Grashälmchen heraussuchen"

Knappschaftskrankenhaus Bochum. Im Erdgeschoss des Südflügels der Klinik beginnt hinter einer verschlossenen Tür das Reich von Susanne Klein-Scory. Sie leitet das DNA-Labor der Klinik. Hier gehört es schon zur Routine, das Fischen von DNA aus dem Blut von Patienten für eine Liquid Biopsy:
"Dazu muss ich mich erst mal sauber anziehen, denn das Ganze ist eine sehr empfindliche Methode und dazu muss man dann entsprechend auch alles schützen, damit keine Kontamination an die Geräte oder an irgendetwas drankommt. Ich ziehe mir Handschuhe an und eben schnell einen Kittel und dann kann ich ihnen das zeigen.
Das ist ein Einmalkittel, der danach weggeworfen wird, den ich natürlich schon bereitgelegt hatte."
In ihr Labor kommen täglich Blutproben aus der Krebsstation. Die Patienten haben schon die Diagnose Krebs. Doch was sind seine genetischen Eigenarten? Diese Frage soll hier im Labor beantwortet werden:
"Da sind also ganz viele normale Fragmente drin, die auch freigesetzt werden ins Blut, aber eben auch Fragmente, die von den Tumorzellen stammen. Und diese Fragmente der Tumorzellen, die gezielt herauszufischen, das ist eigentlich die Aufgabe, die man sich stellt."
Die technischen Hürden sind enorm.
"Es ist so, als würden sie einen großen Heuhaufen in ganz kleine Portionen einteilen und dann das einzige grüne Grashälmchen heraussuchen. So ungefähr ist das. Und das tun wir hier bei diesem Verfahren."
Als erstes muss Susanne Klein-Scory die Blutproben vorbereiten. Mit Hilfe einer Zentrifuge trennt sie die roten und weißen Blutkörperchen ab. Übrig bleibt das Blutplasma, darin schwimmt die DNA. Nach weiteren Aufarbeitungsschritten werden die Proben auf winzige Töpfchen verteilt und in einen weißen Kasten geschoben: die eigentliche Analysemaschine. Susanne Klein-Scory:
"Wenn sie jetzt da unten sich mal bücken und da rein schauen, dann sehen sie, wie da so ein kleiner Arm von einem Töpfchen zum nächsten fährt."
Einzelne Krebs-DNA-Fragmente fischt Klein-Scory nun mit einer Art molekularem Angelhaken heraus. Sie nutzt dabei eine bekannte Eigenschaft: DNA-Stränge ziehen sich gegenseitig an wie Magnete, dann nämlich wenn sie genau die gegengleiche Buchstabenfolge besitzen.
Der Trick ist, einen kurzen DNA-Strang zu bauen, der exakt zur Krebs-DNA passt, die im Patientenblut vermutet wird. Jahrelange Krebsforschung hat die Sequenzen vieler Krebsgene aufgedeckt. Obendrein kennen die Forscher Gene, die in gleich mehreren Krebsarten vorkommen. Sie alle eignen sich als Ködersequenzen für die DNA-Angel.
Die Maschine im Labor von Susanne Klein-Scory spuckt den Fang in Form von Bildern aus: farbige Punkte, die Laborleiterin zeigt einen entsprechenden Ausdruck aus der letzten Analyse. Rot steht für die gesuchte Krebsmutation. Es sind viele rote Punkte zu sehen:
"In dieser Blutprobe des Patienten finden wir mutierte Fragmente, die stammen in der Regel dann von den Tumorzellen beziehungsweise von dem zugrunde gehenden Tumor, den man nicht erreichen kann."
Einen als unheilbar geltenden Krebs in Schach halten
Die Diagnose lautet also Krebs. In diesem Fall Darmkrebs. Die Patientin, von der die Blutprobe stammt, wird im Klinikum einige Stockwerke höher behandelt.
Dr. Alexander Baraniskin: "Hallo Frau Hillbrand. Nehmen sie Platz. Wie geht es ihnen?"
"Gut im Moment, ja."
"Wie haben sie den letzten Zyklus der Chemotherapie vertragen, die letzte Gabe?"
"Gut. Also soweit keine besonderen Nebenwirkungen."
"Keine Übelkeit gehabt, nicht erbrochen?"
"Nee. Zuhause war alles gut. Bisschen die Schleimhäute gereizt für ein, zwei Tage, aber ansonsten alles gut."
Isabel Hillbrand ist gerade einmal 39:
"Ich habe vor drei Jahren die Diagnose Darmkrebs bekommen, der schon metastasiert ist in Lunge und Leber. Als erstes wurde der Tumor im Darm operiert und entfernt und dann begann halt die Chemotherapie."
Sie weiß: Ihr Krebs ist unheilbar. Als sie wegen Darmbeschwerden zum Arzt ging, war es schon zu spät:
"Weil zur Vorsorge ist man ja auch nicht gegangen, weil die Empfehlungen ja auch erst ab 50 oder so sind und da kommt man ja nicht auf die Idee."
Der Onkologe Alexander Baraniskin betreut sie. Alle ihre Krebsherde im Körper zu entfernen, ist unmöglich. Daher ist das Ziel seiner Therapie, ihren Darmkrebs, das Colonkarzinom, mitsamt seinen Metastasen durch Chemotherapien in Schach zu halten. Und zwar so, dass seine Patientin so lange wie möglich mit dem Krebs leben kann. Doch genau dieser Therapieansatz ist eine Gratwanderung:
"Das Problem am Tumor ist, dass insbesondere Colonkarzinome dynamisch sind. Das heißt, es ist keine Erkrankung, die gleich bleibt."

Antikörper-Therapie verschont gesundes Gewebe
Jede Krebsgeschwulst ist genetisch hochvariabel. Sie verändert sich andauernd. Vor allem entwickelt sie Resistenzen: Einzelne Gene mutieren und schon wird der Tumor unempfindlich gegen anfangs so wirksame Medikamente. So war es auch bei Isabel Hillbrand, berichtet Alexander Baraniskin:
"Zu dem Zeitpunkt, als wir den ersten Test bei Frau Hillbrand gemacht haben, hatte sie diese Mutation nicht gehabt und wir haben auch diese Antikörper-Therapien durchgeführt."
Die Antikörper sind ein riesiger Fortschritt in der Krebsmedizin. Sie schädigen nur den Tumor. Gesundes Gewebe wird verschont, die gefürchteten Nebenwirkungen bleiben weitgehend aus. Allerdings holt ein Tumor nach einer Weile für gewöhnlich zum Gegenschlag aus und wird auch gegen Antikörper resistent. Wichtig ist nun, diesen Zeitpunkt möglichst früh zu erkennen. Genau das gelingt mit der Liquid Biopsy, glaubt Alexander Baraniskin:
"Und deswegen kam sie für diese Untersuchung infrage. Wir haben dann bei ihr nachgefragt, ob sie damit einverstanden wäre. Sie war damit einverstanden, sodass wir dann regelmäßig Blut abgenommen haben. Und wir beobachten, wir monitoren jetzt diese Mutation im Blut, ja."
Sobald eine Resistenz-Mutation auftaucht, wird das Medikament abgesetzt und ein anderes gewählt:
"Eine Möglichkeit ist natürlich, dass man immer wieder Gewebe gewinnt, aber das ist bei Metastasen häufig schwer durchzuführen, da es ein invasives Vorgehen ist. Es kann mit Blutungen und Infektionen assoziiert sein und ist meistens mit einem stationären Aufenthalt verbunden, bei dem mehrere medizinische Abteilungen mit eingebunden sind. Deswegen sucht man nach neuen Wegen. Und die naheliegendste Möglichkeit ist die durch eine Blutabnahme."
Alexander Baraniskin sieht im Monitoring von Krebserkrankungen das im Augenblick größte Potential der Liquid Biopsy. Ob es sich in gewonnener Lebenszeit niederschlägt, ist offen. Molekularpathologe Edgar Dahl von der Uniklinik Aachen:
"Kann ich quasi Krebs zu einer chronischen Erkrankung machen, so wie ich bei einer Antibiotikabehandlung, wenn Resistenzen entstehen, ein neues Antibiotikum nehme? Das ist so die Hoffnung, ob das funktioniert, wird sich zeigen, da stehen wir noch ganz am Anfang."
Grundsätzlich eine Ansicht, der Alexander Baraniskin nicht widersprechen kann:
"Wir gehen aber schon davon aus, dass wenn wir eine Therapie absetzen, die nicht wirksam ist und durch eine andere Therapie ersetzen, es theoretisch einen Profit für die Patienten bringen müsste, aber es ist einfach noch zu früh, wir können das durch Zahlen noch nicht belegen."
"Auf Dauer solidarisch kaum finanzierbar"
Gewinnt ein Patient Wochen, Monate oder sogar Jahre dank Liquid Biopsy? Das müssen Studien erst noch zeigen.
Was jetzt schon klar ist: Diese gewonnene Lebenszeit hätte einen hohen Preis. Und das ist wörtlich zu nehmen. Denn das Paket aus Liquid Biopsy plus maßgeschneidertem Medikament ist extrem teuer. Weil die Krebsmittel nicht mehr für große Patientengruppen entwickelt werden, also zum Beispiel solche mit Darmkrebs, sondern für Untergruppen mit einem speziellen Mutationsstatus des Darmkrebses. Die Entwicklungskosten müssen daher von den Firmen über viel weniger Verschreibungen zurückgeholt werden. Edgar Dahl:
"Auch für kleine Gruppen von Patienten, die nur ein bis zwei Prozent der Patienten ausmachen werden Medikamente entwickelt. So dass die Behandlungskosten hier also rasch mal in den Bereich von zehntausend bis hunderttausend Euro gehen können. Ohne, dass im Einzelnen wirklich ein sehr großer Benefit in Form von Jahren gegeben ist, längerer Lebenserwartung. Sondern wir reden dann je nachdem über Monate."
Mittlerweile beschäftigen sich sogar Medizinethiker mit dem Problem. Denn so wünschenswert es ist, jedem einzelnen Patienten alles Erdenkliche zur Verfügung zu stellen, was die Medizin hergibt - was heißt das für andere Patientengruppen? - fragt sich zum Beispiel Jochen Vollmann, Arzt und Medizinethiker von der Uni Bochum:
"Mit dem Label 'Krebs gleich schlimmste Erkrankung, die man sich überhaupt vorstellen kann' wird gegenwärtig noch jede Investition in der sogenannten personalisierten Medizin gerechtfertigt. Da sehe ich aber ein großes Tabu und eine große Aufgabe in unserer Gesellschaft, darüber öffentlich zu diskutieren. Denn die Kosten, die da anfallen, sie sehen es heute schon an den Therapiekosten in der modernen Onkologie, sind auf Dauer solidarisch kaum finanzierbar."
Rein zu Forschungszwecken: die DNA-Analytik der GATC Biotech
Tobias Paprotka: "Hallo! Hier haben wir abgetrennt auch noch das Diagnostiklabor, das heißt, hier haben wir auch noch einen Bereich, wo wir Humanproben bearbeiten."
Unterwegs in den Laboren von GATC Biotech in Konstanz, einem der größten Anbieter von DNA-Sequenzierungen in Europa. Sequenziermaschinen, die Millionen DNA-Buchstaben in wenigen Tagen lesen können, stehen hier in Reih und Glied. Relativ neu im geschäftlichen Portfolio ist die Liquid Biopsy:
"Das ist jetzt ein Roboter, mit dem man DNA isolieren kann. Also hier könnte man auch DNA aus Liquid Biopsy mit extrahieren, der Roboter hat aber noch verschiedene Anwendungen. Also zum Beispiel DNA aus Zellmaterial, aus Gewebe, aus Stuhlproben, also der hat ganz diverse Anwendungsmöglichkeiten."
Tobias Paprotka ist Forschungsleiter bei GATC. Ihr Ziel ist nichts weniger als die Entwicklung der Liquid Biopsy zum massentauglichen und gleichzeitig sicheren Test. Denn die Liquid Biopsy kann nicht nur zum Überwachen von ein oder zwei Krebsgenen eingesetzt werden, so wie es derzeit in ersten Anwendungen bei Tumorpatienten geschieht.
Das Krebsmonitoring kann theoretisch auf alle bekannten Krebsgene ausgeweitet werden - das sind derzeit deutlich über 500. Wahrscheinlich kommen langfristig noch Hunderte weiterer DNA-Mutationen hinzu, die sich als Krebstreiber erweisen. Tobias Paprotka:
"Der Arzt würde uns zunächst eine Blutprobe schicken, aus dieser würden wir dann die zirkulierende DNA isolieren, und diese Sequenzen würden dann auf dieser Maschine analysiert werden."
Rund zweihundert Euro ist derzeit der Mindestpreis, dann geht es um die Suche nach einem einzigen Krebsmarker. Es kann aber auch mehrere tausend Euro kosten, wenn gleich 20 oder mehr Krebsgene gleichzeitig gecheckt werden sollen. Der neueste Test von GATC, soeben vorgestellt, hat immerhin schon 50 Krebsgene im Visier.
Ursprünglich stammt Methode aus Pränataldiagnostik

Dabei ist es erst sechs Jahre her, dass GATC in die blutbasierte DNA-Analytik einstieg. Die Konstanzer haben geradezu Pioniertaten vollbracht, denn sie waren die ersten, die es schafften, die DNA-Blutanalyse zu vermarkten. Allerdings ging es zunächst keineswegs um Krebs:
"Wir haben mit der Analyse von Erbgutstücken im Blut im Jahre 2010 angefangen und da sozusagen Methodiken entwickelt, wie man sehr sensitiv diese Erbgutfragmente analysieren kann und eben entsprechend damit eine pränatale Diagnose durchführen kann."
Die Pränataldiagnostik war die erste Anwendung der DNA-Analyse aus Blut. "Praena" heißt das entsprechende Produkt, weltweit der erste Test für Ungeborene, bei dem eine einfache Blutprobe der werdenden Mutter reicht. Darin schwimmt auch DNA des Fötus. In Konstanz checkt man sie auf Erbgutveränderungen wie Trisomie 21.
Für GATC wurde der Praena-Test zum Verkaufsschlager. Und er war entscheidender Wegbereiter für die Flüssigbiopsie. Tobias Paprotka:
"Vom grundsätzlichen Prinzip der Methodik ist das sehr ähnlich. Also man muss sich vorstellen, diese DNA-Stücke sind zu einer sehr geringen Menge im Blut vorhanden, das heißt, man braucht sehr spezialisierte Methoden, um diese DNA zu isolieren und dann muss man entsprechend nachsehen: Wo kommt diese DNA her? Das kann zum einen vom Fötus kommen bei der pränatalen Diagnostik, sie kann aber auch von einem Tumor kommen und vom Tumor aus ins Blut abgegeben werden. Und die Methodik, diese DNA zu isolieren und dann das Erbgut zu analysieren, ist bei beiden Methoden gleich."
Die größte Herausforderung war zunächst, die winzigen Mengen an gesuchter DNA im Blut zuverlässig zu finden und zu entschlüsseln. Denn ob bei Schwangeren oder bei Krebspatienten: Der Anspruch an die Treffsicherheit ist enorm. Eine Diagnose auf Trisomie 21, die sich als falsch herausstellt - katastrophal. Ebenso eine falsche Krebsdiagnose:
"Die Schwierigkeit ist im Prinzip die Effizienz dieser Geschichte. Man fängt mit ganz wenig an und man will am Ende noch dieses ganz wenig in seiner Sequenziermaschine haben. Für jeden Prozessschritt, bei dem man sagen wir mal nur zehn Prozent verliert, kommt am Ende weniger raus und man bekommt weniger Information. Das heißt, hier jeden Schritt zu optimieren und zu gucken, dass man bei jedem Schritt das Maximum herausholt, das ist die technische Schwierigkeit bei dieser Geschichte."
Ist die Effizienz der DNA-Suche zu gering, könnten Spuren von Krebs im Blut übersehen werden. Das Ergebnis der Liquid Biopsy lautet dann "kein Krebs", obwohl der Patient doch irgendwo einen Tumor sitzen hat. GATC selbst vermarktet seinen Krebstest angesichts der Unsicherheiten daher bis heute rein zu Forschungszwecken.
Untersucht wird das Blut von Patienten, die bereits wissen, dass sie Krebs haben. Sie alle werden parallel mit den üblichen Verfahren überwacht wie zum Beispiel Biopsie oder Röntgen:
"Das ist eine reine Forschungsdienstleistung. Das Produkt ist auch zugeschnitten für die klinische Forschung."
Doch bei aller Vorsicht, auch seitens der Industrie - die Nachfrage steigt zusehends:
"Also man merkt wirklich, dass das Interesse der Kunden von uns, der Mediziner, wächst und dass wir auch sehr viele Anfragen zu diesen Themen bekommen."
"Sie schönen aufgrund eigenen kommerziellen Interesses"
Wenn Krebs im Körper entsteht, kommen wahrscheinlich tausende verschiedener Erbgutfehler als Ursache infrage. Bekannt sind einige hundert. Also wonach genau suchen, um das Urteil "Krebs" sicher aussprechen zu können? Selbst wenn bekannte, in vielen Krebsarten verbreitete so genannte Onkogene gefunden werden - heißt ihr Erscheinen automatisch Krebs? Und bedeutet umgekehrt ihr Fehlen in jedem Fall Entwarnung? Niemand kann das derzeit beantworten.
Während manche Forscher also darum ringen, die Liquid Biopsy als verlässliche Informationsquelle für Krebsdiagnosen erst zu etablieren, sind andere da weniger zurückhaltend. 2015 hat die US-amerikanische Firma Pathway Genomics die erste kommerzielle Liquid Biopsy zur Krebsfrüherkennung auf den Markt gebracht. Auch andere Firmen bringen sich in Stellung. Jochen Vollmann:
"Diese Angebote sind häufig unseriös. Denn sie versprechen eine Sicherheit, die sie nicht halten können. Und da gibt es aus meiner Sicht erhebliche ethische Probleme. Sie sagen nicht die Wahrheit, sondern sie schönen aufgrund eigenen kommerziellen Interesses."
Noch fehlen Erfahrung und Vergleichsdaten zu den Gen-Schnipseln im Blut. Um die zu erheben, seien die kommerziellen Tests durchaus gefragt, räumt Medizinethiker Jochen Vollmann ein:
"Das heißt, sie bestimmen eine Vielzahl - dieser Service ist schon richtig - aber sie suggerieren, dass sie diese Zahlen interpretieren können und im Einzelfall einer gesundheitlichen Situation sicher zuordnen können. Aber das können sie gegenwärtig nicht."
Die Fallstricke der Methode zeigen sich gerade dort, wo ihr größtes Potential schlummert. In der Früherkennung von Krebs.
Gängige Früherkennungsmethoden sind häufig unangenehm oder wenig sensibel
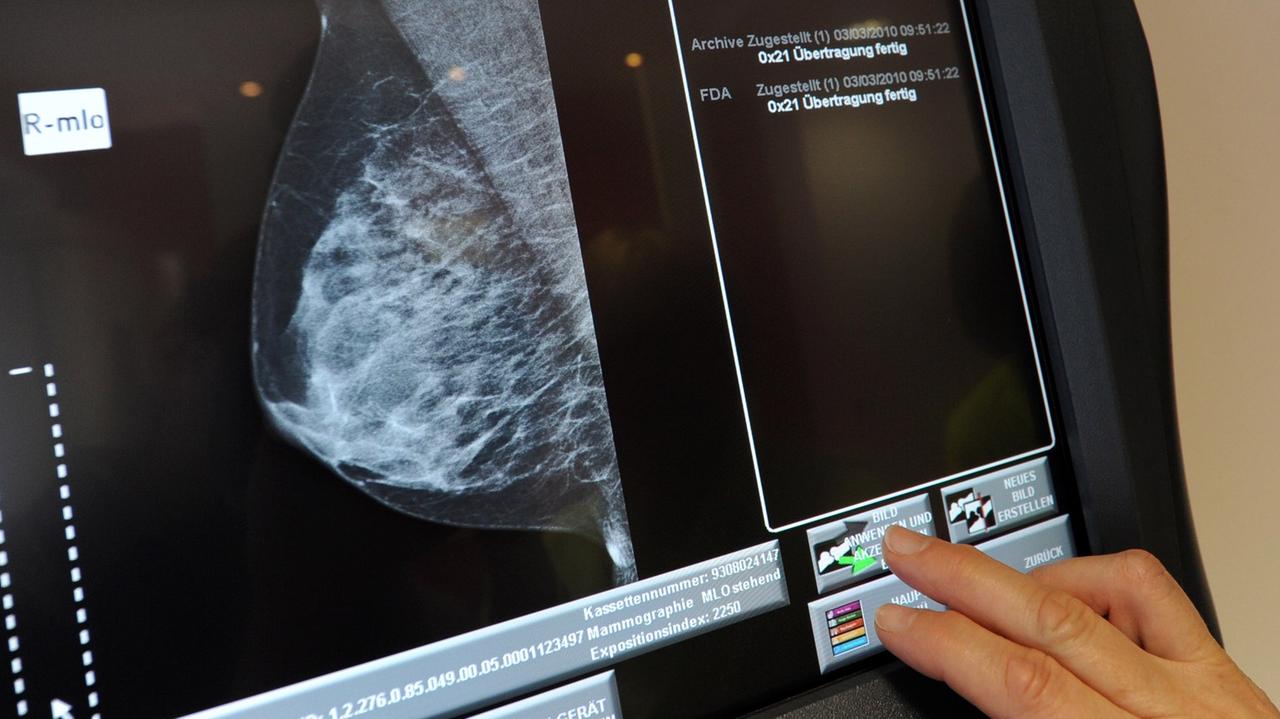
"Wenn es ihnen anfängt, unangenehm zu werden, dann sagen sie bitte was."
"Ich nehme hier Platz?"
"Ja, ich nehme jetzt die Brust, ich drücke jetzt, die Schulter ganz locker lassen. Nicht helfen, wunderbar. Ist das so in Ordnung?"
"Ja, es geht so."
"Okay, dann gehen wir jetzt raus und machen die Aufnahme."
Die Mammographie der Brust, eine gängige Früherkennungsmethode - sehr unangenehm, verbunden sogar mit einer Strahlenbelastung. Andere Vorsorge-Checks wie die Tastuntersuchung der Prostata oder ein Stuhltest erkennen Krebs erst im fortgeschrittenen Stadium.
Dagegen was für eine Vision: Einmal im Jahr zum Arzt, ein kleiner Piks für die Blutentnahme - und nach ein paar Tagen bekommen Sie Entwarnung oder aber eine Krebs-Diagnose im absoluten Frühstadium. Torsten Paprotka:
"Das ist auf alle Fälle denkbar, aber es wird sicher noch ein paar Jahre dauern, bis das Ganze realisiert ist. Im Moment sind wir noch in der Phase, wo eigentlich die Grundlagenforschung dominiert. Das heißt, man evaluiert, wie sicher sind entsprechende Analysen, wie hoch kann man entsprechende Wahrscheinlichkeiten setzen, gibt es vielleicht sogar Marker, mit denen man eine absolut sichere Diagnose stellen kann?"
Torsten Paprotka von GATC weiß sehr gut: Wenn es so weit ist, wird es für sein Unternehmen eine Goldgrube ohnegleichen. Denn dann ginge es nicht um Tests für tausende von Krebspatienten wie zurzeit, sondern für viele Millionen gesunde Menschen, die alle Vorsorge mit einem einfachen Bluttest machen wollen. Der Aachener Pathologe Edgar Dahl sieht diese Zukunft mit gemischten Gefühlen:
"Das Problem besteht mit einer Liquid-Biopsy-Früherkennung von Tumoren, dass wir im Blut Veränderungen finden, die durchaus signifikant sein können, aber früher als jedes bildgebende Verfahren."
Das kann Folgen haben, sagt Torsten Paprotka:
"Das Schlimmste, was man sich vorstellen kann, ist: Jemand bekommt gesagt, 'wir haben hier einen Marker gefunden, sie haben Krebs' - aber dann kann man den Krebs nicht finden."
Patienten würden in Angst und Schrecken versetzt, ohne ihnen adäquat helfen zu können. Weitere Möglichkeit: Im Blut ist Krebs-DNA, aber der Patient ist dennoch völlig gesund. Klaus Pantel, Onkologe am Krebszentrum Hamburg:
"Wir lernen gerade, dass bei alternden Menschen, also nicht Patienten, sondern jeder über Mitte 50, dass wir dort vermehrt Tumor-ähnliche DNA-Fragmente im Blut finden. Das heißt, es ist nicht so einfach, wie man sich das ursprünglich vorgestellt hat: Wir nehmen jetzt eine besonders häufige Tumormutation - und da sind wir mit unserer Krebsdiagnostik. Und es ist glaube ich nicht damit getan, einfach mehr Krebsdiagnosen zu schaffen."
Jochen Vollmann: "Und da haben sie genau das Problem von Überdiagnostik, von einer Kette von Diagnostik und Behandlung, die sie anwerfen, wo man sagen kann: Einer Vielzahl von Patienten würde es besser gehen, wenn sie erst gar nicht in diese Mühle von Diagnostik und Therapie gekommen wären."
Der Exot der Liquid-Biopsy-Welt
Am Krebszentrum der Universität Hamburg leitet Klaus Pantel das Institut für Tumorbiologie. Auch ihm geht es um die Krebsdiagnose aus Blut. Nur seine Strategie ist eine andere:
"Das ist das Gerät. Der Kasten kann Tumorzellen aus dem Blut anreichern und sie auch sichtbar machen."
Die meisten Forscher setzen weltweit auf DNA als den Teil eines Tumors, den es zu finden und zu analysieren gilt. Klaus Pantel ist in der Liquid-Biopsy-Welt ein gewisser Exot. Warum fischt er nach Zellen?
"Die Antwort ist total einfach: Viele, viele Informationen, die wir brauchen, um Therapien vorhersagen zu können, können sie nicht durch die Analyse der DNA alleine bekommen. Das ist nur ein eingeschränkter, sicherlich sehr interessanter Bereich, aber nur ein eingeschränkter."
Tatsächlich schwimmen im Blut von Krebspatienten auch vereinzelt intakte Tumorzellen, und die liefern umfassendere Informationen über den Krebs als die geschredderte DNA. Rein technisch ist das Abfischen aus Blutproben dagegen eine noch größere Herausforderung:
"Wir kriegen üblicherweise eine Blutprobe von zehn Millilitern, das ist in der Klinik auch eine Größe, die man gut abnehmen kann, und wir haben bei Patienten, die in einem ganz frühen Stadium sind, also gerade diagnostiziert, noch keine Streuung als Metastasierung sichtbar, da haben wir dann manchmal auch nur eine oder zwei Tumorzellen in diesen zehn Millilitern."
Einsatzgebiet Krebsnachsorge
Eine oder zwei Krebszellen. Bei mehreren Millionen Blutzellen. Mittlerweile gelingt es, auch diese sprichwörtlichen Nadeln aus dem Heuhaufen herauszuholen, zum Beispiel über ultrafeine Filter. Und tatsächlich sind die Hamburger damit jetzt einen großen Schritt vorangekommen. Sie untersuchten Patienten, die eigentlich als von Krebs geheilt galten, also keinen mit üblichen Methoden detektierbaren Krebs mehr in sich trugen. Und überwachten ihr Rückfallrisiko:
"Ein Beispiel aus der Brustkrebsstudie, die wir vor kurzem veröffentlicht haben, hat gezeigt: Wenn wir fünf oder mehr Zellen pro diesen zehn Millilitern finden, dann ist das Risiko, einen Rückfall zu erleiden, vierfach erhöht. Und das ist schon ein substantieller Wert."
Ein weiteres Einsatzgebiet für die Liquid Biopy tut sich auf: die Krebsnachsorge. Allerdings gilt auch hier: Die Entwicklung steht ganz am Anfang. Die Forscher selbst warnen vor jeder Euphorie.
Im Knappschaftskrankenhaus Bochum wartet Isabel Hillbrand, die 39-jährige Darmkrebspatientin mit Metastasen in Lunge und Leber, auf ihre Tomographie. Sie wird zeigen, ob die Krebsherde in ihrem Körper auf die Antikörper-Therapie weiter ansprechen oder ob sie resistent geworden sind. Ihr Arzt hat ihr die Liquid Biopsy erklärt: dass die vielen Blutabnahmen dazu dienen, ihre Tumore zusätzlich zu überwachen. Isabel Hillbrand:
"Dass man keine Punktion machen muss, ist natürlich auch eine Erleichterung."
Sie hat schon mehrfach die Therapie auf Anraten ihres Arztes Alexander Baraniskin wechseln müssen. Denn die Metastasen fingen irgendwann wieder an zu wachsen:
"Das ist natürlich nicht immer ganz einfach. Aber im Laufe der Jahre hat man sich halt daran gewöhnt."
Alexander Baraniskin: "Im Prinzip können sie nach der CT-Untersuchung direkt nach Hause gehen und dann stellen sie sich wahrscheinlich übermorgen noch mal vor bei uns, dann besprechen wir, wie es weiter geht."
Isabel Hillbrand: "Das ist jetzt halt mein Leben und man hofft natürlich durch neue Therapien, dass man doch irgendwie immer noch mal was findet und so viel Zeit wie möglich kriegt."
Es sprach: Daniel Berger
Ton und Technik: Andreas Fulford
Regie: Claudia Kattanek, Redaktion: Christiane Knoll
Online: Felix von Massenbach
Produktion: Deutschlandfunk 2016
Ton und Technik: Andreas Fulford
Regie: Claudia Kattanek, Redaktion: Christiane Knoll
Online: Felix von Massenbach
Produktion: Deutschlandfunk 2016