"Hallo, Frau Westerhaus. Kommen Sie rein. Haben Sie gut her gefunden?"
Berlin-Köpenick. In einer kleinen Seitenstraße wohnt das Ehepaar Schröer.
"Einfach durchlaufen und dann rechts ins Zimmer."
Auf dem Esstisch Stapel von Papier. Hier saß André Schröer im April und hat uns eine lange Mail geschrieben. Akribisch listet er auf, was in der Parkinson-Forschung vor sich geht. Ganz offensichtlich ist Herr Schröer tief eingetaucht in die Materie.
Berlin-Köpenick. In einer kleinen Seitenstraße wohnt das Ehepaar Schröer.
"Einfach durchlaufen und dann rechts ins Zimmer."
Auf dem Esstisch Stapel von Papier. Hier saß André Schröer im April und hat uns eine lange Mail geschrieben. Akribisch listet er auf, was in der Parkinson-Forschung vor sich geht. Ganz offensichtlich ist Herr Schröer tief eingetaucht in die Materie.
"Eigentlich wollte ich bis 67 arbeiten gehen, aber die Arbeitgeber hatten nicht so das richtige Interesse an mir und dann hab ich gesagt: O.k., ich habe ein neues Projekt, das Projekt ist meine Frau. Und wenn man was erreichen will, dann muss man sich schon ein bisschen dahinter klemmen. Ja, das ist so."
Einzelnen Patienten hätten Zelltherapien geholfen. Doch in Deutschland werde die Forschung blockiert. Darüber sollte der Deutschlandfunk doch mal berichten.
Erste Symptome sind unauffällig
Angelika Schröer erscheint kurz im Wohnzimmer. Ihre Bewegungen sind langsam, wie in Zeitlupe. Angelika begrüßt mich nur kurz und zieht sich dann wieder ins Schlafzimmer zurück. Ihr Mann André hatte mich vorgewarnt. Angelika ist nur dann ansprechbar, wenn ihre Medikamente wirken. Die Symptome begannen vor zehn Jahren, erzählt André. Er bemerkte sie als erster.
"Sie lief dann durch den Garten und hatte die Arme senkrecht hängen, wie bei einem kleinen Soldaten. Und ich hab gesagt: ‚Hey, was machst du da, deine Arme hängen einfach so, die müssen doch schlenkern‘, wie man eben einfach so normalerweise läuft. Habe aber überhaupt keinen Zusammenhang mit irgendeiner Erkrankung oder so gesehen. Und dann kam meine Frau eines Tages nach Hause und sagte: ‚Ja, wenn ich da so vor mehreren Handwerkern spreche, sie hat da Schulungen gemacht, dann wird meine Stimme immer leiser und ich kann nicht mehr richtig kräftig sprechen.‘ Da haben wir uns auch noch nichts weiter bei gedacht. Und dann sagte meine Frau: ‚Meine Handschrift hat sich verändert. Ich schreibe ganz, ganz klein, wie bei deiner Tante.‘ Und dann ist sie zum Arzt gegangen und dann stellte sich das eben raus, dass sie Parkinson hat."
"Sie lief dann durch den Garten und hatte die Arme senkrecht hängen, wie bei einem kleinen Soldaten. Und ich hab gesagt: ‚Hey, was machst du da, deine Arme hängen einfach so, die müssen doch schlenkern‘, wie man eben einfach so normalerweise läuft. Habe aber überhaupt keinen Zusammenhang mit irgendeiner Erkrankung oder so gesehen. Und dann kam meine Frau eines Tages nach Hause und sagte: ‚Ja, wenn ich da so vor mehreren Handwerkern spreche, sie hat da Schulungen gemacht, dann wird meine Stimme immer leiser und ich kann nicht mehr richtig kräftig sprechen.‘ Da haben wir uns auch noch nichts weiter bei gedacht. Und dann sagte meine Frau: ‚Meine Handschrift hat sich verändert. Ich schreibe ganz, ganz klein, wie bei deiner Tante.‘ Und dann ist sie zum Arzt gegangen und dann stellte sich das eben raus, dass sie Parkinson hat."
Diagnose: Parkinson - Prognose: Unheilbar
Angelika Schröer ist da erst 58. Sie und ihr Mann hatten sich auf das Rentenalter gefreut. Die Welt bereisen und viel Zeit mit den Enkelkindern verbringen. Das war der Plan.
"Die Ärzte haben damals gesagt, es ist unheilbar, hier haben wir ein paar Tabletten und Tschüss. Und meine Frau kam nach Hause und war völlig deprimiert. Und ich hab mir gesagt, das kann einfach nicht sein, dass so eine Krankheit so einfach als unheilbar bezeichnet wird."
Gesucht wurde damals aber längst nach einem Durchbruch, auch am Institut von Agnete Kirkeby an der Universität Kopenhagen. Ihr Team entwickelt eine Stammzell-Therapie gegen Parkinson.
"Ja und das habe ich sehr intensiv verfolgt, weil ich gemerkt habe, das scheint die einzige Methode zu sein, die überhaupt bisher Erfolg gebracht hat. Die nicht nur die Krankheit gestoppt, sondern tatsächlich auch zu einer wesentlichen Verbesserung geführt hat. Das war eigentlich der Ansatz gewesen."
Agnete Kirkeby: "Ich wünschte, ich könnte den Schröers sagen, dass sie sich als Teilnehmer für eine klinische Studie bewerben können und dass wir sie aufnehmen können. Wir wissen, dass viele Menschen an unserer Therapie interessiert sind und wir arbeiten so hart, wie wir können, um diese Behandlung so schnell wie möglich in die Anwendung zu bringen."
André liest Originalveröffentlichungen. Fast täglich schreibt er E-Mails an Forscher und Organisationen. Ich bin beeindruckt, wie selbstverständlich er mit medizinischen Fachbegriffen jongliert.
"Wieviel Zeit verwenden Sie so pro Tag?" - "Viel, also ein paar Stunden habe ich eigentlich immer verwendet pro Tag. Es ist wie Arbeiten gehen. Ich bin eigentlich Ingenieur, ich hab bloß gelernt, wenn man etwas Vernünftiges auf die Beine stellen will, muss relativ viel Gehirnschmalz reingesteckt werden."
"Die Ärzte haben damals gesagt, es ist unheilbar, hier haben wir ein paar Tabletten und Tschüss. Und meine Frau kam nach Hause und war völlig deprimiert. Und ich hab mir gesagt, das kann einfach nicht sein, dass so eine Krankheit so einfach als unheilbar bezeichnet wird."
Gesucht wurde damals aber längst nach einem Durchbruch, auch am Institut von Agnete Kirkeby an der Universität Kopenhagen. Ihr Team entwickelt eine Stammzell-Therapie gegen Parkinson.
"Ja und das habe ich sehr intensiv verfolgt, weil ich gemerkt habe, das scheint die einzige Methode zu sein, die überhaupt bisher Erfolg gebracht hat. Die nicht nur die Krankheit gestoppt, sondern tatsächlich auch zu einer wesentlichen Verbesserung geführt hat. Das war eigentlich der Ansatz gewesen."
Agnete Kirkeby: "Ich wünschte, ich könnte den Schröers sagen, dass sie sich als Teilnehmer für eine klinische Studie bewerben können und dass wir sie aufnehmen können. Wir wissen, dass viele Menschen an unserer Therapie interessiert sind und wir arbeiten so hart, wie wir können, um diese Behandlung so schnell wie möglich in die Anwendung zu bringen."
André liest Originalveröffentlichungen. Fast täglich schreibt er E-Mails an Forscher und Organisationen. Ich bin beeindruckt, wie selbstverständlich er mit medizinischen Fachbegriffen jongliert.
"Wieviel Zeit verwenden Sie so pro Tag?" - "Viel, also ein paar Stunden habe ich eigentlich immer verwendet pro Tag. Es ist wie Arbeiten gehen. Ich bin eigentlich Ingenieur, ich hab bloß gelernt, wenn man etwas Vernünftiges auf die Beine stellen will, muss relativ viel Gehirnschmalz reingesteckt werden."
Hype und Hoffnung: Stammzellen als universelle Ersatzteile
1998 gelang es Forschern erstmals, Stammzellen aus Embryonen im Labor zu kultivieren. Damals herrschte Goldgräberstimmung: Alles schien möglich: Querschnittsgelähmte sollten wieder laufen, Blinde wieder sehen, altersschwache Herzen wieder kräftig pumpen.
Aus embryonalen Stammzellen können alle Zellen des menschlichen Körpers entstehen. Herzzellen, Nierenzellen oder aber die Zellen, die im Gehirn von Parkinson-Patienten absterben. Doch bisher gibt es keine Krankheit, die mit Stammzellen aus Embryonen geheilt werden kann. Wie stehen die Chancen bei Parkinson? Wie weit sind Agnete Kirkeby und ihre Kollegen anderswo, und: sind sie weit genug für Angelika Schröer? Agnete Kirkeby:
"Natürlich gibt es jede Menge Geschichten in den Medien, wenn eine neue Technologie erforscht wird. Und die Menschen erwarten dann, dass der Durchbruch viel früher kommt. Die Forschung braucht einfach Zeit. Jetzt haben wir aber tatsächlich einen spannenden Moment erreicht, in dem wir vom Labor in die medizinische Praxis gehen."
Aus embryonalen Stammzellen können alle Zellen des menschlichen Körpers entstehen. Herzzellen, Nierenzellen oder aber die Zellen, die im Gehirn von Parkinson-Patienten absterben. Doch bisher gibt es keine Krankheit, die mit Stammzellen aus Embryonen geheilt werden kann. Wie stehen die Chancen bei Parkinson? Wie weit sind Agnete Kirkeby und ihre Kollegen anderswo, und: sind sie weit genug für Angelika Schröer? Agnete Kirkeby:
"Natürlich gibt es jede Menge Geschichten in den Medien, wenn eine neue Technologie erforscht wird. Und die Menschen erwarten dann, dass der Durchbruch viel früher kommt. Die Forschung braucht einfach Zeit. Jetzt haben wir aber tatsächlich einen spannenden Moment erreicht, in dem wir vom Labor in die medizinische Praxis gehen."
Medikamente wirken immer nur für einige Stunden
In Berlin-Köpenick steht ein perfekter Milchkaffee vor mir. Angelika geht es inzwischen deutlich besser:
"Ich hab immer Phasen, wo es mir nicht so gut geht. Das ist nach der ersten Einnahmetablette, die nehme ich morgens um sechs. Und um neun hört die Wirkung auf und dann muss ich die nächsten Medikamente nehmen und von neun an bis zehn, also eine Stunde, geht’s mir dann immer schlecht. Das heißt, ich kann kaum sprechen, der Kiefer verkrampft, der Hals verkrampft, der Kopf wird schief und dann kann man nicht viel unternehmen. Und so geht’s dann am Nachmittag und am Abend auch noch mal."
"Ich hab immer Phasen, wo es mir nicht so gut geht. Das ist nach der ersten Einnahmetablette, die nehme ich morgens um sechs. Und um neun hört die Wirkung auf und dann muss ich die nächsten Medikamente nehmen und von neun an bis zehn, also eine Stunde, geht’s mir dann immer schlecht. Das heißt, ich kann kaum sprechen, der Kiefer verkrampft, der Hals verkrampft, der Kopf wird schief und dann kann man nicht viel unternehmen. Und so geht’s dann am Nachmittag und am Abend auch noch mal."
Ursache für das Zellsterben im Gehirn unbekannt
In den ersten Jahren führte Angelika Schröer ein weitgehend normales Leben. Sie bekam Medikamente, die L-Dopa enthalten, eine Vorstufe des Dopamins, von dem in ihrem Gehirn zu wenig gebildet wird. Doch im Laufe der Jahre gehen bei Parkinson-Patienten immer mehr Dopamin-bildende Zellen zugrunde. Warum, wissen Forscher immer noch nicht. Obwohl sie seit vielen Jahren nach den Ursachen suchen. Ein lösliches Protein namens α-Synuclein scheint an der Entstehung der Krankheit beteiligt zu sein. Es kommt natürlicherweise im Gehirn vor und reguliert die Dopamin-Ausschüttung. Bei Parkinson-Patienten lagert es sich in den so genannten Lewy-Körperchen ab, die typisch für die Krankheit sind. Forscher versuchen inzwischen, eine Art Impfung zu entwickeln, um die Nervenzellen zu schützen. Manche Forscher halten das für sinnvoller, als Parkinson-Patienten neue Zellen zu verabreichen.
Was nutzt Früherkennung, wenn es keine Heilung gibt?
Auch in die Früherkennung wird viel Geld investiert. André Schröer findet das unnütz:
"Es gibt eben nichts, womit man die Krankheit ausbremsen oder überhaupt stoppen könnte. Deswegen ist die Suche nach einer Methode, dass man die Krankheit rechtzeitig feststellt, diagnostiziert, ist eigentlich relativ hilflos. Ich hab auch einen Wissenschaftler darüber referieren gehört, der hat gesagt: ‚Ja was hilft es denn? Dann ist der Mensch noch deutlich früher verwirrt und ist noch deprimierter, als er vielleicht sowieso ist, wenn die Krankheit dann irgendwann erkennbar auftritt.‘"
"Es gibt eben nichts, womit man die Krankheit ausbremsen oder überhaupt stoppen könnte. Deswegen ist die Suche nach einer Methode, dass man die Krankheit rechtzeitig feststellt, diagnostiziert, ist eigentlich relativ hilflos. Ich hab auch einen Wissenschaftler darüber referieren gehört, der hat gesagt: ‚Ja was hilft es denn? Dann ist der Mensch noch deutlich früher verwirrt und ist noch deprimierter, als er vielleicht sowieso ist, wenn die Krankheit dann irgendwann erkennbar auftritt.‘"
Welche Behandlungsmethode hat wirklich Potential?
André Schröer weiß, dass die verfügbaren Medikamente seiner Frau irgendwann nicht mehr helfen werden. Ihr wird es schlechter gehen, eines Tages wird sie nicht mehr laufen können, die Krankheit wird auch auf andere Bereiche des Gehirns übergreifen.
"Als bei meiner Frau Parkinson diagnostiziert wurde, da habe ich mal versucht abzutesten, was gibt es denn eigentlich für Möglichkeiten. Und dann war es natürlich so, ich musste eine Reihe von Dingen aussortieren. Also zum Beispiel Akupunkturnadeln, die man irgendwo setzt; oder andere Medikamente, es werden ja Unmengen von Medikamenten zur Zeit ausprobiert immer noch. Aber es gab eigentlich nichts, wo ich sagen konnte, das ist es. Und dann stieß ich auf die Forschergruppe um Professor Anders Björklund und Professor Malin Parmar, in Schweden, an der Lund Universität, und die haben ja schon seit Mitte der Achtziger Jahre versucht, durch Zelltransplantationen solche Behandlungserfolge zu erzielen."
"Als bei meiner Frau Parkinson diagnostiziert wurde, da habe ich mal versucht abzutesten, was gibt es denn eigentlich für Möglichkeiten. Und dann war es natürlich so, ich musste eine Reihe von Dingen aussortieren. Also zum Beispiel Akupunkturnadeln, die man irgendwo setzt; oder andere Medikamente, es werden ja Unmengen von Medikamenten zur Zeit ausprobiert immer noch. Aber es gab eigentlich nichts, wo ich sagen konnte, das ist es. Und dann stieß ich auf die Forschergruppe um Professor Anders Björklund und Professor Malin Parmar, in Schweden, an der Lund Universität, und die haben ja schon seit Mitte der Achtziger Jahre versucht, durch Zelltransplantationen solche Behandlungserfolge zu erzielen."
Erste Versuche mit fetalen Zellen in Schweden
Es war der Anfang, ein erster Versuch, Parkinson nicht mehr nur zu lindern, sondern die zerstörten Zellen zu ersetzen. Das Team in Schweden hatte mehreren Patienten fetales Hirngewebe injiziert. Also unreife Hirnzellen aus Abtreibungen. Die Hoffnung: Im Gehirn der Patienten würden sich diese in Dopamin-bildende Nervenzellen verwandeln und die abgestorbenen Zellen ersetzen. Auch anderswo transplantierten Forscher Gewebe aus abgetriebenen Feten.
Doch die Ergebnisse waren uneindeutig: Einzelnen Parkinson-Patienten ging es besser, anderen jedoch schlechter als vor der Transplantation. 2003 wurden die Versuche überall gestoppt.
Agnete Kirkeby hat viele Jahre in Lund gearbeitet und war dort an der Studie beteiligt. Sie hat eine Erklärung für die widersprüchlichen Ergebnisse:
"Wir glauben, dass sie so unterschiedlich ausfielen, weil das Gewebe auf sehr unterschiedlichen Wegen verabreicht wurde. Manche Patienten bekamen zu wenige Zellen und das Gewebe wurde nicht bei allen an der gleichen Stelle ins Gehirn injiziert. Wir haben aus diesen Versuchen sehr viel gelernt und verstehen nun, was wir machen müssen und was wir besser sein lassen."
Doch die Ergebnisse waren uneindeutig: Einzelnen Parkinson-Patienten ging es besser, anderen jedoch schlechter als vor der Transplantation. 2003 wurden die Versuche überall gestoppt.
Agnete Kirkeby hat viele Jahre in Lund gearbeitet und war dort an der Studie beteiligt. Sie hat eine Erklärung für die widersprüchlichen Ergebnisse:
"Wir glauben, dass sie so unterschiedlich ausfielen, weil das Gewebe auf sehr unterschiedlichen Wegen verabreicht wurde. Manche Patienten bekamen zu wenige Zellen und das Gewebe wurde nicht bei allen an der gleichen Stelle ins Gehirn injiziert. Wir haben aus diesen Versuchen sehr viel gelernt und verstehen nun, was wir machen müssen und was wir besser sein lassen."

Ethische Bedenken bei der Verwendung von Embryonen
Inzwischen hat man das Verfahren weiterentwickelt, und die Versuche wieder aufgenommen.
Ursprünglich war geplant, im Rahmen der Transeuro-Studie auch in Freiburg Parkinson-Patienten zu behandeln. Darauf hat das Ehepaar Schröer 2013 seine Hoffnung gesetzt:
"Ich hatte mich in Freiburg beworben, habe mich dort in die Liste der für die Phase zwei Studie vorhandenen Probanden mit eintragen lassen. Ich vermute, die Chance war nicht so sehr groß, weil die Auslese schon vorher getroffen worden war. Aber ich hab mir wenigstens die Hoffnung gemacht. Und meine Frau dort sozusagen mal angekündigt, dass sie Interesse hat."
Doch dann stieg die Freiburger Arbeitsgruppe aus. Schroer:
"Wie ich heute weiß, wegen der Bedenken, die man hat bei der Verwendung von Stammzellen hatte und noch mehr Bedenken bei der Verwendung von Embryonen, die als Quelle dieser neuronalen Stammzellen dienen."
Jedem Patienten werden bei dem Verfahren Zellen aus mehreren abgetriebenen Feten eingesetzt. Außerdem war der Vorsprung der anderen Transeuro-Gruppen schon groß. In Lund und Cambridge aber wurden Patienten behandelt. Mit Ergebnissen rechnet man frühestens in zwei Jahren.
Ursprünglich war geplant, im Rahmen der Transeuro-Studie auch in Freiburg Parkinson-Patienten zu behandeln. Darauf hat das Ehepaar Schröer 2013 seine Hoffnung gesetzt:
"Ich hatte mich in Freiburg beworben, habe mich dort in die Liste der für die Phase zwei Studie vorhandenen Probanden mit eintragen lassen. Ich vermute, die Chance war nicht so sehr groß, weil die Auslese schon vorher getroffen worden war. Aber ich hab mir wenigstens die Hoffnung gemacht. Und meine Frau dort sozusagen mal angekündigt, dass sie Interesse hat."
Doch dann stieg die Freiburger Arbeitsgruppe aus. Schroer:
"Wie ich heute weiß, wegen der Bedenken, die man hat bei der Verwendung von Stammzellen hatte und noch mehr Bedenken bei der Verwendung von Embryonen, die als Quelle dieser neuronalen Stammzellen dienen."
Jedem Patienten werden bei dem Verfahren Zellen aus mehreren abgetriebenen Feten eingesetzt. Außerdem war der Vorsprung der anderen Transeuro-Gruppen schon groß. In Lund und Cambridge aber wurden Patienten behandelt. Mit Ergebnissen rechnet man frühestens in zwei Jahren.
Stammzell-Verwandlung schon vor der Transplantation
Agnete Kirkeby verfolgt inzwischen in Kopenhagen einen parallelen Weg. So wie auch andere Forscherteams in Großbritannien und den USA verwendet sie nicht mehr Gewebe aus abgetriebenen Feten, sondern überzählige Embryonen aus künstlichen Befruchtungen. Daraus gewinnt Kirkeby Stammzellen, die sie im Labor dazu bringt, sich in sogenannte dopaminerge Neurone zu verwandeln. Das sind die Vorläufer der Zellen, die bei Parkinson-Patienten absterben. Damit wüssten die Zellen schon vor der Transplantation, in welchen Zelltyp sie sich verwandeln sollen.
Kirkebys Stammzell-Labor liegt im sechsten Stock eines modernen Gebäudes.
"Sie müssen diese Plastiküberschuhe anziehen, damit wir keinen Staub in das Labor tragen…Wir kommen jetzt in unser Zellkultur-Labor. Hier züchten wir die Zellen und differenzieren sie. Das bedeutet, dass wir aus den Stammzellen so genannte dopaminerge Nervenzellen herstellen. Das hier ist aber nur unser Forschungslabor. Die eigentlichen Zellen, die wir dann den Patienten verabreichen wollen, werden in London in einem spezialisierten Labor gezüchtet. Hier können wir reingehen."
Die Forscherin öffnet die Tür zum Labor. Ein enger Raum mit Wärmeschränken auf der linken und Labortischen auf der rechten Seite. In den Wärmeschränken stapeln sich runde Plastikschälchen, in denen eine pinkfarbene Flüssigkeit schwimmt.
"Sie müssen diese Plastiküberschuhe anziehen, damit wir keinen Staub in das Labor tragen…Wir kommen jetzt in unser Zellkultur-Labor. Hier züchten wir die Zellen und differenzieren sie. Das bedeutet, dass wir aus den Stammzellen so genannte dopaminerge Nervenzellen herstellen. Das hier ist aber nur unser Forschungslabor. Die eigentlichen Zellen, die wir dann den Patienten verabreichen wollen, werden in London in einem spezialisierten Labor gezüchtet. Hier können wir reingehen."
Die Forscherin öffnet die Tür zum Labor. Ein enger Raum mit Wärmeschränken auf der linken und Labortischen auf der rechten Seite. In den Wärmeschränken stapeln sich runde Plastikschälchen, in denen eine pinkfarbene Flüssigkeit schwimmt.
Pluripotente Stammzellen als Ausgangsmaterial
"In diesen Inkubatoren züchten wir die Zellen bei 37 Grad, damit sie sich so wohl fühlen, als wären sie im menschlichen Körper. Und in der pinkfarbenen Flüssigkeit befinden sich Nährstoffe und alle Wachstumsfaktoren, die die Zellen brauchen. Wir können uns die Zellen ja mal unter dem Mikroskop anschauen."
Mit bloßem Auge sind sie nicht zu erkennen, erst unter dem Mikroskop.
"Wenn ich mir diese Zellen anschaue, sehe ich, dass es pluripotente embryonale Stammzellen sind. Wir nennen diesen Zustand undifferenziert. Das bedeutet, dass sie in der Lage sind, jeden Zelltyp im menschlichen Körper zu bilden."
Aus diesen Zellen können die Forscher also theoretisch Herzzellen, Nierenzellen oder Nervenzellen entstehen lassen.
"In diesem Zustand können wir die Zellen für immer und ewig halten. Wir können sie vermehren, auf neue Plastikschalen verteilen, sie einfrieren, an unsere Kollegen verschicken. Das ist ein großer Vorteil von Stammzellen: Wir können genügend Zellen für die ganze Welt herstellen, wenn wir wollen. Dazu vermehren wir sie einfach so lange, bis wir so viele Patienten damit behandeln können, wie wir wollen."
Mit bloßem Auge sind sie nicht zu erkennen, erst unter dem Mikroskop.
"Wenn ich mir diese Zellen anschaue, sehe ich, dass es pluripotente embryonale Stammzellen sind. Wir nennen diesen Zustand undifferenziert. Das bedeutet, dass sie in der Lage sind, jeden Zelltyp im menschlichen Körper zu bilden."
Aus diesen Zellen können die Forscher also theoretisch Herzzellen, Nierenzellen oder Nervenzellen entstehen lassen.
"In diesem Zustand können wir die Zellen für immer und ewig halten. Wir können sie vermehren, auf neue Plastikschalen verteilen, sie einfrieren, an unsere Kollegen verschicken. Das ist ein großer Vorteil von Stammzellen: Wir können genügend Zellen für die ganze Welt herstellen, wenn wir wollen. Dazu vermehren wir sie einfach so lange, bis wir so viele Patienten damit behandeln können, wie wir wollen."
Immer wieder neue Embryonen nötig
Das klingt, als bräuchten die Forscher nie mehr neue menschliche Embryonen. Doch die Stammzelllinien verändern sich mit der Zeit. Sie müssen ausgetauscht werden, dafür sind immer wieder neue Embryonen nötig. Agnete Kirkeby holt eine zweite Schale aus dem Wärmeschrank und legt sie unter das Mikroskop. Darin befinden sich Stammzellen, die sich schon in Nervenzellen differenziert, also verwandelt haben.
"Hier können Sie sehen, dass die Zellen sehr dünne lange Arme bilden. Das sind die Neurite, die im Gehirn der Patienten Kontakt zu anderen Nervenzellen aufnehmen. Und diese Kommunikation ist absolut notwendig, damit die Transplantation funktioniert."
Die Zellen sehen mit ihren Fortsätzen wie kleine in die Länge gezogene Sterne aus. Genauso wie die Nervenzellen aus den Biologie-Büchern. Vor ein paar Jahren habe ich mir in einem anderen Labor Herzzellen angeschaut, die Forscher aus Stammzellen gezüchtet hatten. Auch damals war ich beeindruckt: Die winzigen Zellen pulsierten jede für sich wie ein kleines Herz. Die Forscher haben schon viel geschafft: Sie wissen, wie sie die embryonale Stammzellen dazu bringen, sich wie gewünscht zu verwandeln.
"Hier können Sie sehen, dass die Zellen sehr dünne lange Arme bilden. Das sind die Neurite, die im Gehirn der Patienten Kontakt zu anderen Nervenzellen aufnehmen. Und diese Kommunikation ist absolut notwendig, damit die Transplantation funktioniert."
Die Zellen sehen mit ihren Fortsätzen wie kleine in die Länge gezogene Sterne aus. Genauso wie die Nervenzellen aus den Biologie-Büchern. Vor ein paar Jahren habe ich mir in einem anderen Labor Herzzellen angeschaut, die Forscher aus Stammzellen gezüchtet hatten. Auch damals war ich beeindruckt: Die winzigen Zellen pulsierten jede für sich wie ein kleines Herz. Die Forscher haben schon viel geschafft: Sie wissen, wie sie die embryonale Stammzellen dazu bringen, sich wie gewünscht zu verwandeln.
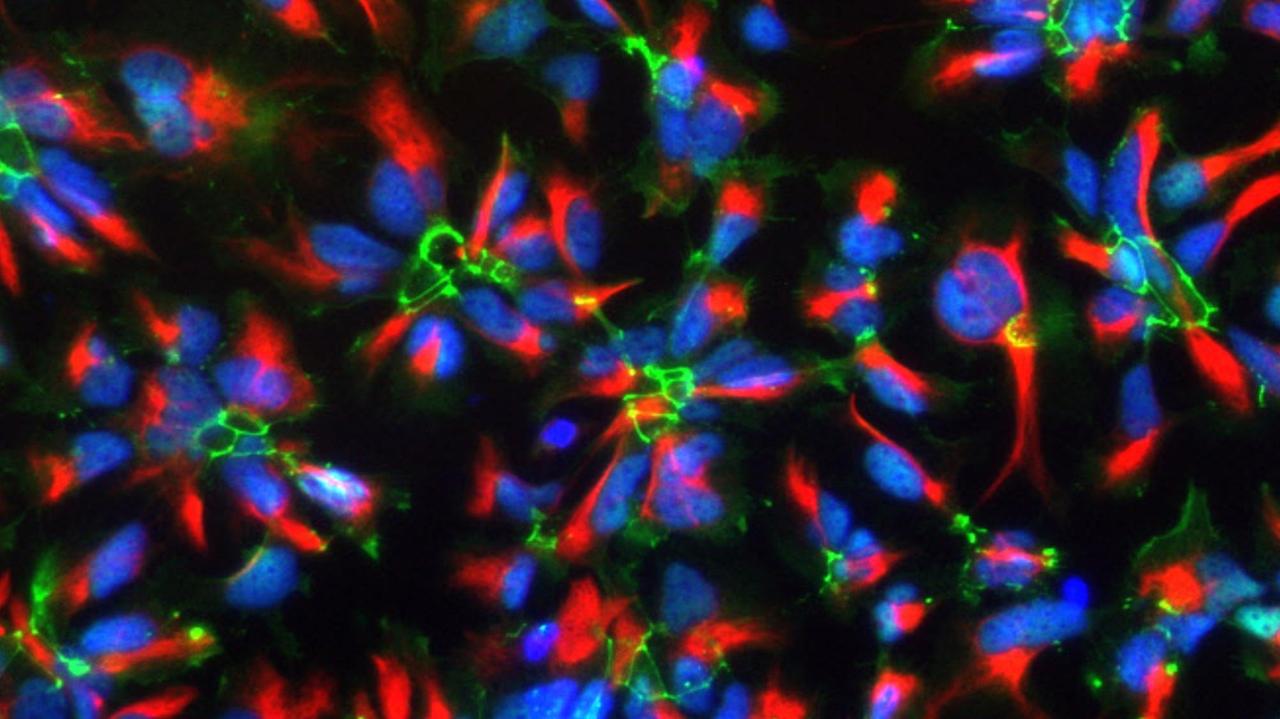
Die ethisch attraktivere Alternative: iPS-Zellen
Zwischenzeitlich gelang ein anderer Meilenstein mit sogenannten iPS-Zellen. Menschliche Embryonen in der Forschung zu verwenden ist ethisch umstritten. Denn aus ihnen könnte – zumindest theoretisch – ein ganzer Mensch entstehen. iPS dagegen, also "induzierte pluripotente Stammzellen", sind ganz normale erwachsene Zellen, die in den ursprünglichen, embryonalen Zustand zurückversetzt werden. Sie lassen sich anstatt aus Embryonen aus eigenen Zellen der Patienten gewinnen. Kirkeby:
"Theoretisch sollten diese beiden Typen von Stammzellen identisch sein. Oft sind sie es auch. Aber bei iPS-Zellen besteht die Gefahr, dass wir Mutationen auslösen. Es ist ein ziemlich turbulenter Prozess für eine ausdifferenzierte Körperzelle, wenn wir aus ihr wieder eine Stammzelle machen. Es kann sein, dass sie ein epigenetisches Gedächtnis behält, dass sie sich also noch daran erinnert, zum Beispiel mal eine Blutzelle gewesen zu sein. Und weil wir in unserer Studie erstmals Patienten behandeln, wollen wir solche Risiken ausschließen."
"Theoretisch sollten diese beiden Typen von Stammzellen identisch sein. Oft sind sie es auch. Aber bei iPS-Zellen besteht die Gefahr, dass wir Mutationen auslösen. Es ist ein ziemlich turbulenter Prozess für eine ausdifferenzierte Körperzelle, wenn wir aus ihr wieder eine Stammzelle machen. Es kann sein, dass sie ein epigenetisches Gedächtnis behält, dass sie sich also noch daran erinnert, zum Beispiel mal eine Blutzelle gewesen zu sein. Und weil wir in unserer Studie erstmals Patienten behandeln, wollen wir solche Risiken ausschließen."
Körpereigene iPS-Zellen lösen keine Immunantwort aus
Es gibt auch Forscher, die jetzt schon auf iPS-Zellen setzen. Der japanische Forscher Jun Takahashi hat 2018 einen ersten Parkinson-Patienten mit diesen induzierten Zellen behandelt, sechs weitere sollen folgen. Auch in den USA laufen Studien an. Der Vorteil: Die Testpersonen werden zumindest in den ersten Monaten nach der Transplantation keine Medikamente einnehmen müssen, die das Immunsystem unterdrücken. Denn weil iPS-Zellen aus den Körperzellen der Patienten entstehen, werden sie nicht abgestoßen. Kirkeby:
"Die Herausforderung ist in beiden Fällen, dass die Stammzellen jeden Zelltyp des menschlichen Körpers bilden können, und wir müssen ihre Verwandlung genau kontrollieren. Und das ist der schwierigste Teil der Forschung, wenn man als Stammzell-Biologin arbeitet. Und das ist auch der Grund, warum die Forschung so viele Jahre dauert."
"Die Herausforderung ist in beiden Fällen, dass die Stammzellen jeden Zelltyp des menschlichen Körpers bilden können, und wir müssen ihre Verwandlung genau kontrollieren. Und das ist der schwierigste Teil der Forschung, wenn man als Stammzell-Biologin arbeitet. Und das ist auch der Grund, warum die Forschung so viele Jahre dauert."
Risikofaktor übersteigerter Forscher-Ehrgeiz
Andere haben sich diese Zeit nicht genommen, und behandelten viel zu früh Patienten. Der italienische Chirurg Paolo Macchiarini behauptete 2013, Luftröhren durch Gerüste ersetzen zu können, die er mit Stammzellen behandelt hatte. In wissenschaftlichen Artikeln beschrieb er seine Patienten als genesen. Doch dann starben sie qualvoll. Kirkeby:
"Es gibt seitdem viele zusätzliche Auflagen in Schweden, um die klinischen Versuche sicher zu machen. Einen weiteren Skandal will niemand."
Agnete Kirkeby hat ihre Stammzellen immer wieder an Versuchstieren getestet, auch um Tumore auszuschließen. Jetzt scheint sie sich ihrer Sache sicher zu sein:
"Wir haben die Stammzellen in den vergangenen 10 Jahren mehr als 1200 Ratten transplantiert. Deshalb sind wir sehr zuversichtlich, dass sie funktionieren und sicher sind. Wir erwarten, dass wir die ersten Patienten 2021 behandeln können. Weil dieses Verfahren aber sehr neu und experimentell ist, haben wir von den Behörden die Auflage bekommen, nur eine sehr kleine Gruppe von Patienten zu behandeln. Nur acht Personen werden eine Zelltransplantation bekommen. Sie stammen aus Lund in Schweden und aus Cambridge in Großbritannien."
"Es gibt seitdem viele zusätzliche Auflagen in Schweden, um die klinischen Versuche sicher zu machen. Einen weiteren Skandal will niemand."
Agnete Kirkeby hat ihre Stammzellen immer wieder an Versuchstieren getestet, auch um Tumore auszuschließen. Jetzt scheint sie sich ihrer Sache sicher zu sein:
"Wir haben die Stammzellen in den vergangenen 10 Jahren mehr als 1200 Ratten transplantiert. Deshalb sind wir sehr zuversichtlich, dass sie funktionieren und sicher sind. Wir erwarten, dass wir die ersten Patienten 2021 behandeln können. Weil dieses Verfahren aber sehr neu und experimentell ist, haben wir von den Behörden die Auflage bekommen, nur eine sehr kleine Gruppe von Patienten zu behandeln. Nur acht Personen werden eine Zelltransplantation bekommen. Sie stammen aus Lund in Schweden und aus Cambridge in Großbritannien."
Erfolg der Stammzell-Therapie noch längst nicht ausgemacht
Angelika Schröer ist nicht unter diesen acht Patienten. Sie wird warten müssen, bis die Ergebnisse dieser Pilotstudie ausgewertet sind. André Schröer:
"Ich hatte eigentlich schon die Hoffnung, dass eine Transplantation im Jahr 2015 oder 2016 ihr noch rechtzeitig helfen kann. Es ist aber eben so, dass es vor 2021 wahrscheinlich gar nichts wird, wie sich das jetzt zur Zeit darstellt."
Frühestens nach drei Jahren wird sich zeigen, ob sich Kirkebys transplantierte Stammzellen tatsächlich zu funktionstüchtigen, Dopamin-produzierenden Nervenzellen weiter entwickeln. Oder ob sie einfach nur absterben. Das ist bei Patienten geschehen, denen nach einem Herzinfarkt Stammzellen aus dem Knochenmark verabreicht wurden. Und selbst wenn die frischen Zellen die Funktion der abgestorbenen Zellen im Gehirn von Parkinson-Patienten übernehmen, bleiben Fragezeichen. Bei einzelnen Patienten, denen fetales Hirngewebe injiziert worden war, entdeckten die Forscher neue Lewy-Körperchen, also die typischen Ablagerungen, die für die Parkinson-Krankheit verantwortlich gemacht werden. Bei diesen Patienten konnte die Frischzellen-Kur die Krankheit aufhalten, aber nicht stoppen.
"Ich hatte eigentlich schon die Hoffnung, dass eine Transplantation im Jahr 2015 oder 2016 ihr noch rechtzeitig helfen kann. Es ist aber eben so, dass es vor 2021 wahrscheinlich gar nichts wird, wie sich das jetzt zur Zeit darstellt."
Frühestens nach drei Jahren wird sich zeigen, ob sich Kirkebys transplantierte Stammzellen tatsächlich zu funktionstüchtigen, Dopamin-produzierenden Nervenzellen weiter entwickeln. Oder ob sie einfach nur absterben. Das ist bei Patienten geschehen, denen nach einem Herzinfarkt Stammzellen aus dem Knochenmark verabreicht wurden. Und selbst wenn die frischen Zellen die Funktion der abgestorbenen Zellen im Gehirn von Parkinson-Patienten übernehmen, bleiben Fragezeichen. Bei einzelnen Patienten, denen fetales Hirngewebe injiziert worden war, entdeckten die Forscher neue Lewy-Körperchen, also die typischen Ablagerungen, die für die Parkinson-Krankheit verantwortlich gemacht werden. Bei diesen Patienten konnte die Frischzellen-Kur die Krankheit aufhalten, aber nicht stoppen.

Bewegung ist wichtig für Parkinson-Patienten
Angelikas Diagnose liegt 10 Jahre zurück. Noch können die Schröers zusammen in ihrem kleinen Garten Tischtennis spielen.
"Sie sind ja richtig gut!" "Naja, wir haben schon mindestens zwei Wochen nicht mehr gespielt. Das ist die Kunst, meine Frau spielt auch ein bisschen unkonventionell und ich muss mich anstrengen."
Neben der Tischtennisplatte steht ein Gewächshaus. Angelika Schroer:
"Das ist so ein Urwald geworden in diesem Jahr, die Tomaten. Ganz viele waren das. Ich habe es jetzt einfach wachsen lassen, weil das schaffe ich alles gar nicht mehr.‘‘
Die Krankheit dominiert zusehends den Alltag. Eine Kiefersperre erschwert das Sprechen. André Schröer:
"Ich versuche auch möglichst viele Dinge im Haushalt zu übernehmen und es gibt natürlich auch andere Dinge, die wir jetzt nicht mehr machen können. Es wird auch immer weniger. Für einen Parkinson-Patienten ist es sehr wichtig, dass er sich viel bewegt. Und meine Frau hat mich mal irgendwann dazu überredet, zur Tanzschule zu gehen und das haben wir jetzt so ein bisschen versucht, das zu aktivieren, aber es kann passieren - und das ist in der letzten Zeit tatsächlich häufiger passiert - dass wir hinfahren und wieder umdrehen. Weil sie nicht in der Lage ist, aus dem Auto auszusteigen oder dann mit mir zu tanzen."
"Sie sind ja richtig gut!" "Naja, wir haben schon mindestens zwei Wochen nicht mehr gespielt. Das ist die Kunst, meine Frau spielt auch ein bisschen unkonventionell und ich muss mich anstrengen."
Neben der Tischtennisplatte steht ein Gewächshaus. Angelika Schroer:
"Das ist so ein Urwald geworden in diesem Jahr, die Tomaten. Ganz viele waren das. Ich habe es jetzt einfach wachsen lassen, weil das schaffe ich alles gar nicht mehr.‘‘
Die Krankheit dominiert zusehends den Alltag. Eine Kiefersperre erschwert das Sprechen. André Schröer:
"Ich versuche auch möglichst viele Dinge im Haushalt zu übernehmen und es gibt natürlich auch andere Dinge, die wir jetzt nicht mehr machen können. Es wird auch immer weniger. Für einen Parkinson-Patienten ist es sehr wichtig, dass er sich viel bewegt. Und meine Frau hat mich mal irgendwann dazu überredet, zur Tanzschule zu gehen und das haben wir jetzt so ein bisschen versucht, das zu aktivieren, aber es kann passieren - und das ist in der letzten Zeit tatsächlich häufiger passiert - dass wir hinfahren und wieder umdrehen. Weil sie nicht in der Lage ist, aus dem Auto auszusteigen oder dann mit mir zu tanzen."
Therapie-Option Hirnschrittmacher
Noch gibt es Optionen, die Angelika offen stehen: Die Wirkstoffe können anstatt als Tablette über Pumpen direkt in den Darm oder in die Haut abgegeben werden. Das verhindert Wirkungsschwankungen. Seit vielen Jahren setzen Forscher auch so genannte Hirnschrittmacher ein. Diese "tiefe Hirnstimulation" genannte Therapie hilft vielen Patienten, wenn die Medikamente an Wirkungskraft verlieren. Dabei werden Elektroden in das Gehirn implantiert. Sie regulieren die Aktivität der Nervenzellen. André Schröer:
"Das heilt aber gar nicht die Krankheit, das vermindert die Auswirkungen für einen gewissen Zeitraum, unbestimmt wie lange. Drei Jahre, fünf Jahre, zehn Jahre sind bekannt, wenn sie Glück hat. Aber wird wahrscheinlich dann verhindern, dass sie eine Zelltransplantation bekommen kann. Und ich bin immer noch da so orientiert, dass ich sage, ich möchte das Beste für meine Frau."
"Das heilt aber gar nicht die Krankheit, das vermindert die Auswirkungen für einen gewissen Zeitraum, unbestimmt wie lange. Drei Jahre, fünf Jahre, zehn Jahre sind bekannt, wenn sie Glück hat. Aber wird wahrscheinlich dann verhindern, dass sie eine Zelltransplantation bekommen kann. Und ich bin immer noch da so orientiert, dass ich sage, ich möchte das Beste für meine Frau."
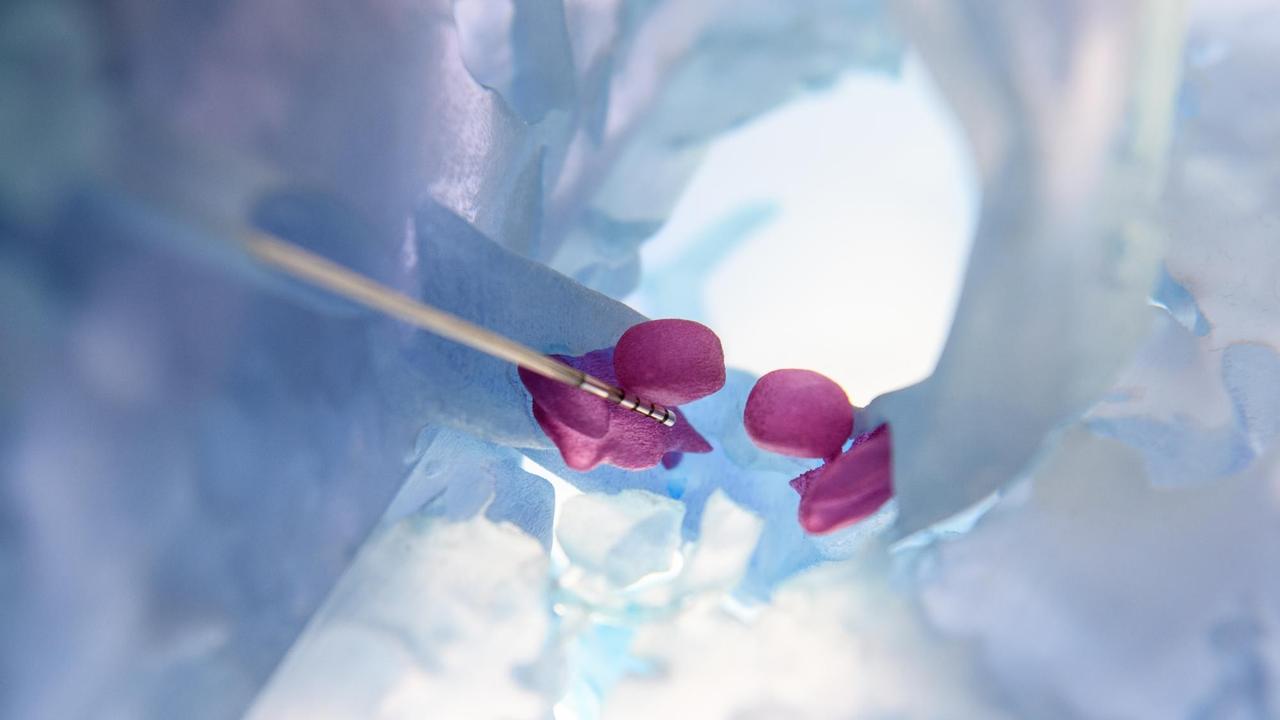
In den meisten klinischen Studien mit Zelltransplantationen können Patienten nicht teilnehmen, wenn sie eine tiefe Hirnstimulation bekommen. Angelika wartet deshalb ab.
Passiert in Deutschland genug im Kampf gegen Parkinson?
Gut vier Millionen Menschen weltweit sind an Parkinson erkrankt. Viele versuchen, sich aktiv in die Forschung einzumischen. So wie André Schröer:
"Und da passiert mir in Deutschland auch viel zu wenig, zu wenig Öffentlichkeit, zu wenig Aktivitäten. Wenn ich da nach Großbritannien schaue, was die machen, wo nicht nur die Patienten selber, sondern auch die Familienangehörigen und Freunde mit eingebunden sind in solche Aktivitäten, um Geld zu sammeln. Diese ganze Forschung mit den humanen Stammzellen wird ja nicht von irgendwelchen Pharma-Unternehmen unterstützt. Das lief zum großen Teil über Spenden. ‚The Cure Parkinsons Trust‘ spendet sehr viel Geld auch für diese Transeuro-Studie und auch sicherlich für die nächstfolgende Studie. Und dass sich jetzt ein Pharma-Unternehmen gefunden hat, man hat gesagt, wir beteiligen uns auch, ist eigentlich nur ein Ergebnis der guten erfolgreichen Arbeit."
"Und da passiert mir in Deutschland auch viel zu wenig, zu wenig Öffentlichkeit, zu wenig Aktivitäten. Wenn ich da nach Großbritannien schaue, was die machen, wo nicht nur die Patienten selber, sondern auch die Familienangehörigen und Freunde mit eingebunden sind in solche Aktivitäten, um Geld zu sammeln. Diese ganze Forschung mit den humanen Stammzellen wird ja nicht von irgendwelchen Pharma-Unternehmen unterstützt. Das lief zum großen Teil über Spenden. ‚The Cure Parkinsons Trust‘ spendet sehr viel Geld auch für diese Transeuro-Studie und auch sicherlich für die nächstfolgende Studie. Und dass sich jetzt ein Pharma-Unternehmen gefunden hat, man hat gesagt, wir beteiligen uns auch, ist eigentlich nur ein Ergebnis der guten erfolgreichen Arbeit."

Wie schnell kann die Forschung "liefern"?
Weil viele Menschen betroffen sind, und weil das Internet ihnen die Möglichkeit gibt, sich zu vernetzen, bringen die Patienten viel in Bewegung. Wie schnell die Forschung liefern kann, ist offen. André Schröer:
"Also es gibt eine ganze Reihe von Änderungen, die so ganz langsam und allmählich Raum greifen. Fernreisen sind unmöglich. Und irgendwann, wenn es dann noch schlechter wird, werden wir wahrscheinlich hier ausziehen müssen. Und dann sitzen wir im Seniorenheim, ist halt so."
"Haben Sie denn das Gefühl, Ihnen rennt so ein bisschen die Zeit weg?"
"Ja. Weil die Erkrankung meiner Frau wirklich schnell voranschreitet offensichtlich. Ja, die Perspektive ist nicht so brillant. Und leider läuft das auch alles sehr langsam zur Zeit."
Agnete Kirkeby:
"Also es gibt eine ganze Reihe von Änderungen, die so ganz langsam und allmählich Raum greifen. Fernreisen sind unmöglich. Und irgendwann, wenn es dann noch schlechter wird, werden wir wahrscheinlich hier ausziehen müssen. Und dann sitzen wir im Seniorenheim, ist halt so."
"Haben Sie denn das Gefühl, Ihnen rennt so ein bisschen die Zeit weg?"
"Ja. Weil die Erkrankung meiner Frau wirklich schnell voranschreitet offensichtlich. Ja, die Perspektive ist nicht so brillant. Und leider läuft das auch alles sehr langsam zur Zeit."
Agnete Kirkeby:
"Ich weiß, dass es für Patienten frustrierend ist, aber es gibt einen Grund, warum die Forschung so lange dauert. Am Ende zahlt es sich aus, wenn wir unsere klinischen Studien nicht überstürzen, sondern diese extra Jahre in die Forschung investieren. Das erhöht die Chancen deutlich."
Höchstalter für Teilnahme an klinischer Studie
André Schröer:
"Ich hab mir diese Studienbeschreibung angeschaut und da gibt es so genannte Ein- und Ausschlusskriterien, die gibt es wahrscheinlich bei jeder Studie, die gemacht wird. Und das höchste Alter war 68 Jahre der Teilnehmer."
Angelika Schröer ist inzwischen 68, und frühestens im Jahr 2023 werden die Forscher wissen, ob die Stammzelltherapie hilft.
"Und das ist für meine Frau dann vielleicht schon zu spät, weil sie dermaßen stark damit behindert ist, auch Schmerzen hat und so, dass sie mehrmals am Tag regelrecht außer Gefecht gesetzt ist. Sie muss sich hinlegen und hat Krämpfe und das wird sie wahrscheinlich so nicht mehr lange durchhalten."
"Was haben wir heute noch als Plan? Enkelkinder sind morgen dran. Dann haben wir ein bisschen freie Zeit, dann können wir noch 'ne Runde Tischtennis spielen."
"Und das ist für meine Frau dann vielleicht schon zu spät, weil sie dermaßen stark damit behindert ist, auch Schmerzen hat und so, dass sie mehrmals am Tag regelrecht außer Gefecht gesetzt ist. Sie muss sich hinlegen und hat Krämpfe und das wird sie wahrscheinlich so nicht mehr lange durchhalten."
"Was haben wir heute noch als Plan? Enkelkinder sind morgen dran. Dann haben wir ein bisschen freie Zeit, dann können wir noch 'ne Runde Tischtennis spielen."
Hoffnung auf baldigen Forschungsdurchbruch
André Schröers Optimismus steckt an. Auch bei unseren Telefonaten hat er immer gute Laune. Oft bringt er mich zum Lachen.
"Das ist wie mit den Optimisten und den Pessimisten. Der Pessimist sagt: Schlimmer kann's nicht kommen. Der Optimist sagt: Oh doch! ."
"Das ist wie mit den Optimisten und den Pessimisten. Der Pessimist sagt: Schlimmer kann's nicht kommen. Der Optimist sagt: Oh doch! ."
"Was ist denn ihre größte Hoffnung?"
"Dass wir bis zu unserem Lebensende möglichst gesund leben können und noch ein bisschen was auf die Beine stellen. Ich mach das ja nicht so einfach aus Quatsch. Ich hab mir das angeguckt: Ihre Eltern, also der Papa, ist weit über 80 geworden. 86 und die Mama 90 Jahre alt, 91. Das heißt, sie hat das Potenzial, 90 Jahre alt zu werden. Mindestens. Ja klar. Und wenn sie jetzt eine Zelltransplantation bekommt, dann kann sie ohne weiteres bis zum 90. Lebensjahr gut leben, gesund leben. Aber das ist mein Ziel, dass es eine langfristige Perspektive für uns beide gibt und das ist glaube ich, nicht zu viel verlangt." Angelika Schröer:
"Ja, meine größte Hoffnung... Dass es schnell geht, dass schnell auf jeden Fall die Forschung in den Zeiten, die sie jetzt angegeben haben bleiben, in den nächsten 2-3 Jahren, dass da was passiert, dass es nicht wieder noch länger dauert."
"Dass wir bis zu unserem Lebensende möglichst gesund leben können und noch ein bisschen was auf die Beine stellen. Ich mach das ja nicht so einfach aus Quatsch. Ich hab mir das angeguckt: Ihre Eltern, also der Papa, ist weit über 80 geworden. 86 und die Mama 90 Jahre alt, 91. Das heißt, sie hat das Potenzial, 90 Jahre alt zu werden. Mindestens. Ja klar. Und wenn sie jetzt eine Zelltransplantation bekommt, dann kann sie ohne weiteres bis zum 90. Lebensjahr gut leben, gesund leben. Aber das ist mein Ziel, dass es eine langfristige Perspektive für uns beide gibt und das ist glaube ich, nicht zu viel verlangt." Angelika Schröer:
"Ja, meine größte Hoffnung... Dass es schnell geht, dass schnell auf jeden Fall die Forschung in den Zeiten, die sie jetzt angegeben haben bleiben, in den nächsten 2-3 Jahren, dass da was passiert, dass es nicht wieder noch länger dauert."
