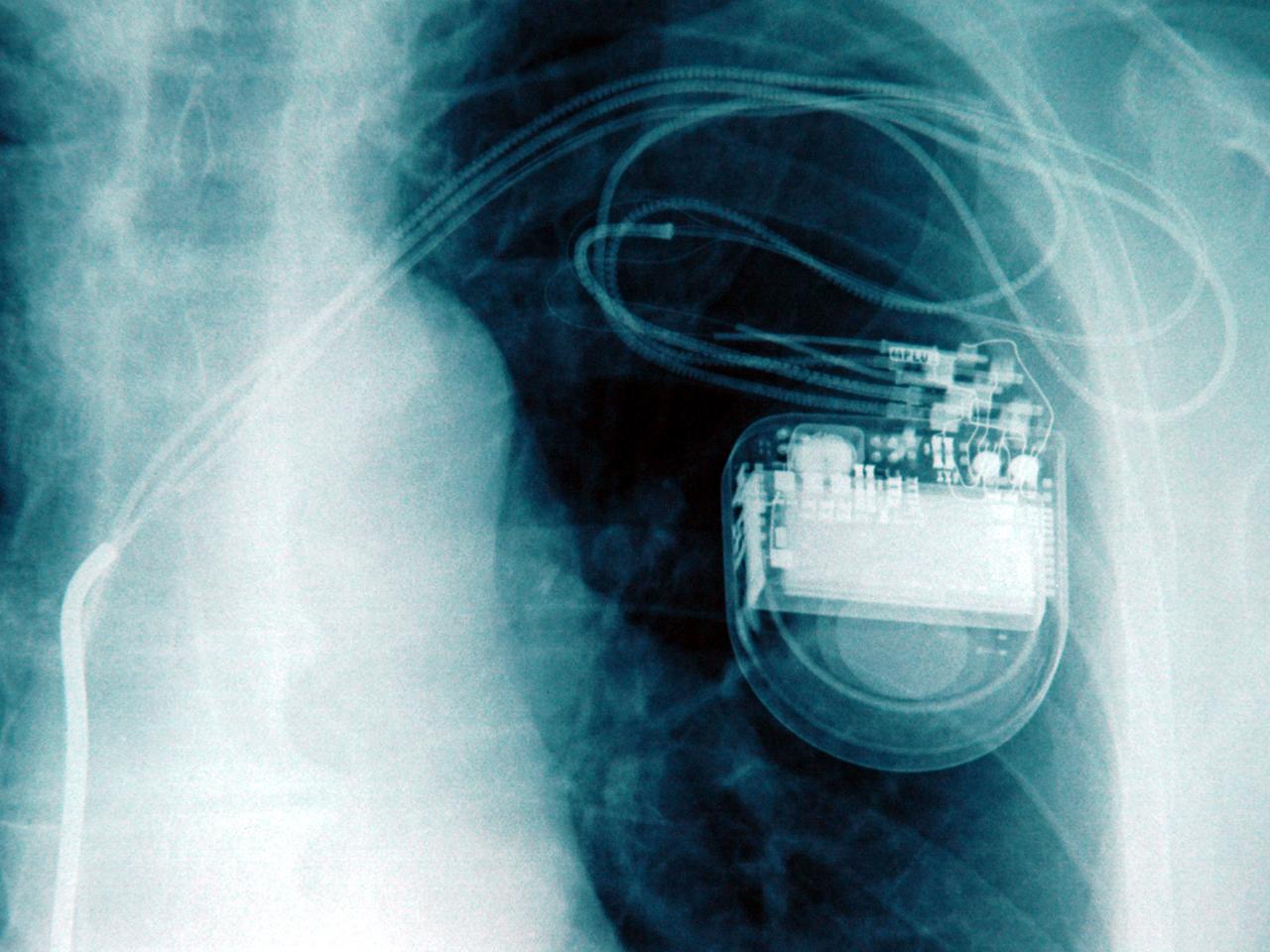
Der ruhige Schlag eines Herzens schwingt immer wieder durch die Räume des "Technoseums" in Mannheim. In einer Sonderausstellung zeigt das Technikmuseum, das zu den größten seiner Art in Deutschland gehört, wie rasant sich die Medizintechnik in den zurückliegenden Jahrhunderten entwickelt hat, und vor allem in den vergangenen Jahrzehnten. Ein Beispiel für diesen Fortschritt sind Apparate, die das Herz im richtigen Rhythmus schlagen lassen, erklärt der Ausstellungsleiter Alexander Siegelen.
"Der erste Herzschrittmacher, den ein Patient mit sich tragen konnte, das war noch ein externer Herzschrittmacher, der wurde an einem Band, sozusagen einem Gurt getragen, und war ein Kästchen von einer Größe von 15 auf 7 Centimeter etwa. Und es gibt heute schon Versuche mit Herzschrittmachern, die praktisch minimalinvasiv über einen Katheter direkt im Herz verankert werden, die dann also wirklich sehr kleine Objekte sind."
Rund 400.000 Medizinprodukte auf dem Markt
Herzschrittmacher gehören zu den besonders komplexen Entwicklungen der Medizintechnik - und auch zu denen, die besonders stark in den menschlichen Körper eingreifen. Insgesamt gibt es rund 400.000 verschiedene Medizinprodukte, von einfachen Pflastern über Röntgengeräte, Skalpelle oder Hüftprothesen bis hin zu künstlichen Herzen. Je nachdem, wie sehr sie die Gesundheit oder gar das Leben gefährden können, sind sie in insgesamt vier verschiedene Risikoklassen eingeteilt.
Bei Wundauflagen etwa geht man von einem geringen Gefahrenpotenzial aus, bei Herzklappen oder künstlichen Gelenken von einem hohen. Das Mannheimer Technoseum zeigt in seiner Ausstellung zur Geschichte allerdings auch, wie schwer sich die Menschen schon immer damit taten, diese Gefahren richtig einzuschätzen. Ob etwa eine Röntgenuntersuchung wirklich notwendig ist und das Risiko der Strahlenbelastung rechtfertigt, wird heute von Fall zu Fall kritisch geprüft. Noch vor gut 50 Jahren war man da lässiger, wie etwa ein Apparat namens "Schukoskop" zeigt, der im Mannheimer Technoseum zu sehen ist. Der mit Holz verkleidete Kasten ist gut einen Meter hoch und hat oben Öffnungen. Das Schukoskop ist nichts anderes als ein Röntgenapparat, erklärt eine Museumsangestellte.
"Die standen in Schuhgeschäften, das heißt, die Kinder standen dann mit den Füßen in diesem Kasten drin, von unten kam die Röntgenstrahlung, und hier gibt es ja mehrere Schlitze, wo man durchgucken konnte, und da konnte die ganze Familie schauen, ob der Schuh dem Kind passt oder nicht. Also hat man sich damals gar keine Gedanken gemacht, wie gefährlich eigentlich Röntgenstrahlen sind."
Inzwischen machen sich Hersteller und Anwender von medizintechnischen Apparaten weit mehr Gedanken über Sicherheit - auch, weil sie durch Vorschriften dazu gezwungen werden. Viele Experten halten diese Vorschriften aber für nicht ausreichend, um einen optimalen Patientenschutz zu gewährleisten.
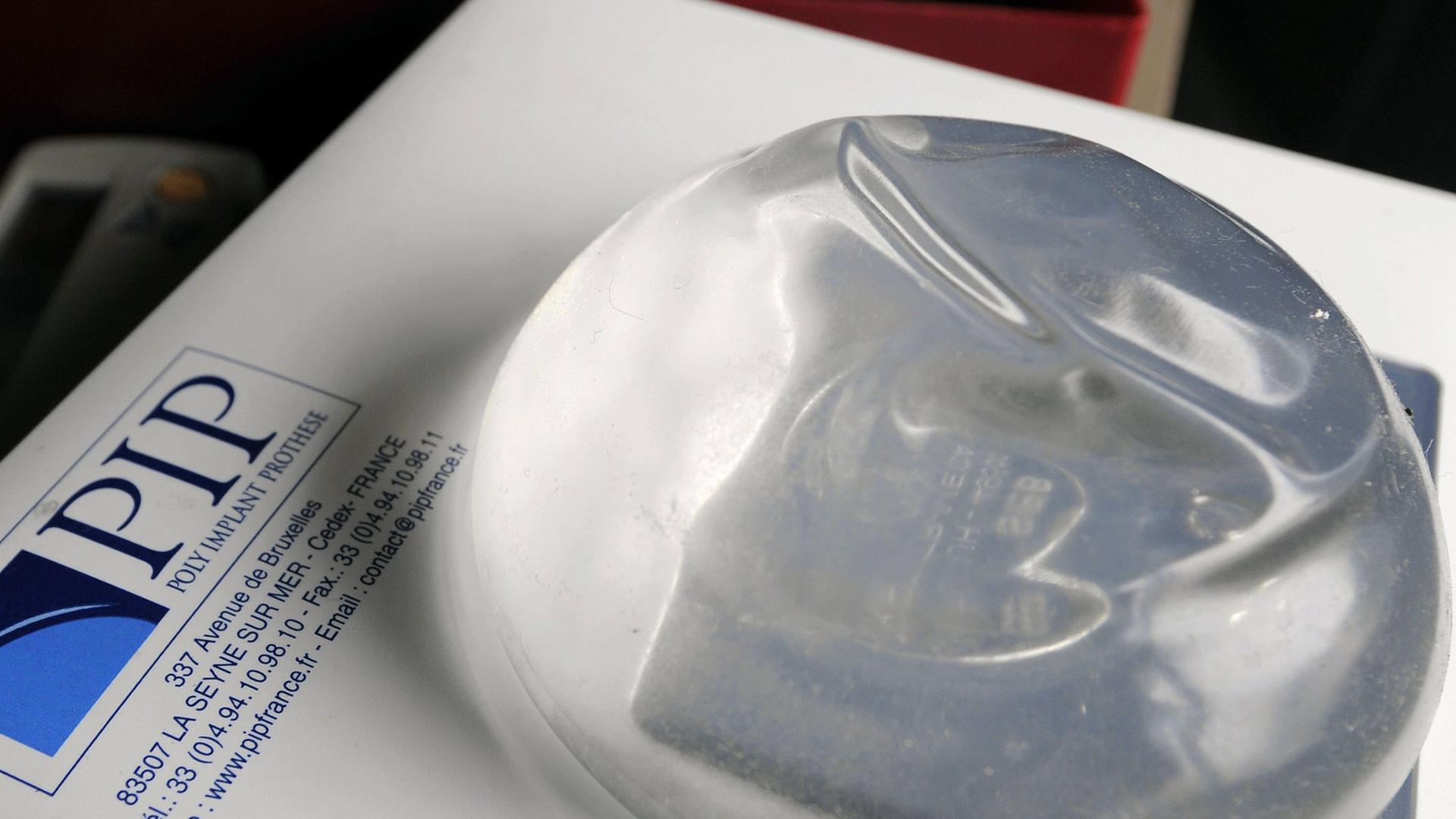
Von den gesetzlichen Krankenkassen etwa ist zu hören, der Skandal um fehlerhafte Brustimplantate, der vor fünf Jahren bekannt wurde, sei auf Mängel im System zurückzuführen, die bis heute nicht beseitigt seien. Die französische Firma PIP hatte über viele Jahre hinweg Brustimplantate mit minderwertigem Industriesilikon befüllt. Alleine in Deutschland haben rund 5.000 Frauen solche Implantate erhalten.
Gerichte befassen sich mit dem Fall PIP
Mehrere Patientinnen und auch die AOK Bayern haben gegen den TÜV Rheinland geklagt, der für die Überwachung der Firma zuständig war - in den bisherigen Instanzen allerdings ohne Erfolg. Nach Ansicht der Gerichte sind die Prüfer bewusst getäuscht worden. Erst heute hat der Bundesgerichtshof entschieden, dass sich zunächst der Europäische Gerichtshof mit der komplizierten Rechtslage befassen muss. Der Vorstands-Chef der AOK Bayern, Helmut Platzer, wünscht sich klarere und strengere Regeln für die Prüfverfahren.
"Die Regelungsdefizite, die in dem Zusammenhang zu beklagen sind, sind immer wieder die gleichen, ganz egal, ob es um Brustimplantate geht, um Herzschrittmacher, Defibrillatoren, ob es um Hüftgelenksersatz geht oder vor Jahr und Tag um Herzklappen. Also, Sie sehen schon an meiner Aufzählung: Man könnte eine ganze Reihe von Themen nennen, die alle in diesen Komplex hineingehören, und wo sich immer wieder und immer wieder gezeigt hat, dass wir eben bei Weitem noch nicht dort sind, was den Patientenschutz angeht, wo wir eigentlich hingelangen wollen."
Auch von anderen Kassen heißt es, Probleme mit fehlerhaften Medizinprodukten seien keine Seltenheit. Christian Soltau, der bei der Techniker Krankenkasse für diesen Bereich zuständig ist, spricht von 1.300 Geschädigten, die alleine seine Versicherung derzeit betreut.
"Wir haben in den letzten Jahren eine Vervierfachung der Risikomeldungen beobachten können. Das ist das Jahr 2000 bis 2013, und das ist für uns schon eine besorgniserregende Zahl, sodass wir uns mit diesem Thema auch intensiv beschäftigen und uns auch im Sinne der Patientensicherheit verstärkt Gedanken machen."
Und nach Einschätzung der Kassen muss man zu den Fällen, die bekannt werden, noch eine hohe Dunkelziffer rechnen. Also Patienten, denen nicht bewusst ist, dass ein Gesundheitsproblem mit einem fehlerhaften Medizinprodukt zu tun hat, oder Patienten, deren Probleme nirgends registriert werden. Nach Ansicht der Krankenkassen liegt ein Grund für die steigende Zahl der Fehlermeldungen darin, dass die Qualität der Medizinprodukte nicht ausreichend geprüft wird.
Hersteller: Mehr Patienten, mehr Problemfälle
Die Hersteller von Prothesen, Herzschrittmachern oder auch Kanülen kommen allerdings zu ganz anderen Ergebnissen, wenn sie die Statistik erklären sollen. Die Zahl etwa der Patienten, die eine künstliche Hüfte erhalten, habe sich in den vergangenen 20 Jahren mehr als verdoppelt, erklärt Joachim Schmitt, Geschäftsführer beim Bundesverband Medizinprodukte. Da sei es logisch, dass auch die Zahl der Problemfälle wachse, meint er. Außerdem gebe es seit einigen Jahren größere Bemühungen der Hersteller und auch des Bundesamts für Arzneimittel und Medizinprodukte, kurz BfArM, Probleme aufzuspüren.
"Die höhere Zahl ist also tatsächlich mit durch den Aufruf und die Aufklärung seitens der Industrie wie aber auch des BfArM selbst gekommen, die betreffenden Anwender zu ermuntern, die betreffenden Meldungen abzugeben."
Auf die Frage, wie sich der rasche Anstieg der Risikomeldungen bei Medizinprodukten erklären lässt, geben Hersteller und Krankenkassen also ganz unterschiedliche Antworten. Die Kassen stehen mit ihren Warnungen vor Risiken aber nicht alleine. Professor Joerg Hasford leitet den Arbeitskreis der Ethik-Kommissionen der Landesärztekammern. Diese Kommissionen prüfen vor allem bei Arzneimitteltests, die von der Industrie oder auch wissenschaftlichen Instituten an Menschen vorgenommen werden, ob sie mit ethischen Standards vereinbar sind. Aber die Ethikkommissionen erhalten auch Anträge auf Studien zu Medizinprodukten, wie etwa sogenannten Stents, die in Blutgefäße eingepflanzt werden, um sie stabil zu halten.
"Wir hatten eine Studie vorliegen, da waren von einem Stent größenordnungsmäßig 3.000 bereits implantiert worden. Dann sollte eine Studie durchgeführt werden, wo man zum ersten Mal die Wirksamkeit dieses Verfahrens untersuchen wollte. Wir konnten das überhaupt nicht glauben, dass man so einen Gefäßersatz in Europa implantieren kann, ohne jede Erfahrung, wie das bei Menschen ist, und schon gar nicht im Vergleich zu therapeutischen Alternativen."
Kritik am Kontrollsystem der Benannten Stellen

Bei Arzneimitteln gilt: Bevor sie auf den Markt gebracht werden, müssen die Hersteller zunächst im Labor und später mit Testpersonen belegen, dass ein neues Medikament wirksam ist und keine unverantwortbaren Nebenwirkungen hat. Bei einem Medizinprodukt hingegen muss der Hersteller lediglich nachweisen, dass es technisch einwandfrei ist, dass also etwa ein Herzschrittmacher keine ungewollten Stromstöße abgibt. Die technische Unbedenklichkeit wird in der Europäischen Union von sogenannten Notified Bodies geprüft und bescheinigt, auf Deutsch heißen sie Benannte Stellen. Die Medizingeräte erhalten dann das CE-Kennzeichen, das auch auf Spielgeräten oder Unterhaltungselektronik zu finden ist. Zu den Benannten Stellen zählen in Deutschland verschiedene TÜV-Organisationen, europaweit können die Hersteller unter rund 70 Benannten Stellen eine aussuchen. Der AOK-Chef Platzer findet das fatal.
Und Joerg Hasford, der den Arbeitskreis der Ethikkommissionen der Ärztekammern leitet, kennt Berichte über "Prüfstellen"-Hopping. So heißt es in der Branche, wenn ein Medizinprodukte-Hersteller sich so lange nach einer Benannten Stelle umsieht, bis er eine gefunden hat, von der er sich eine reibungslose Zusammenarbeit erhofft."Dass ich mir selbst irgendeinen Zertifizierungsanbieter als Hersteller suchen darf, der mir dann bestätigt, dass im Großen und Ganzen das Verfahren, das ich anwende, keine größeren Probleme aufweist. Damit hat sich's schon. Das führt zu einer Scheinsicherheit."
"Die arbeiten ja wirtschaftlich, und ich denke, eine Benannte Stelle, die nun überstreng ist oder, sagen wir mal, nur gesetzeskonform streng ist, hat natürlich möglicherweise einen Nachteil gegenüber einer, die sagt: Eine Hand wäscht die andere und wir kriegen das schon irgendwo hin."
Neben dem "Prüfstellen-Hopping" gibt es in der Medizintechnik-Branche auch den Begriff "Prüfstellen-Shopping". So heißt es, wenn ein Hersteller ein Produkt-Dossier an verschiedene Benannte Stellen schickt, und darauf wartet, welche als erste das Signal gibt, dass sie einen positiven Prüfbescheid ausstellen wird. Für Aufsehen sorgte im Jahr 2012 eine investigative Recherche, an der die angesehene Fachzeitschrift "British Medical Journal" beteiligt war. Sie hat fiktive Unterlagen verschickt, die einer Hüftprothese entsprachen, die vorher bereits einmal auf dem Markt war.
"Die haben eine bereits wegen mangelnder Sicherheit aus dem Verkehr gezogene Hüft-Endoprothese genommen und bei Benannten Stellen vorgelegt, sie möchten es mit einem CE-Kennzeichen versehen lassen. Und die Benannten Stellen waren außerordentlich kooperativ, dieses zu zertifizieren."
Medizintechnikbranche: Überwachungssystem sei verschärft worden
In der Medizintechnikbranche kennt man die Kritik am Kontrollsystem der Benannten Stellen. Roland Prestel, der früher beim TÜV Süd gearbeitet hat und inzwischen zum Medizintechnik-Großkonzern BBraun gewechselt ist, will diese Kritik auch nicht in Bausch und Bogen zurückweisen. Aber es habe sich in den vergangenen Jahren bereits einiges getan, sagt er. Die Benannten Stellen, zu denen in Deutschland die Gesellschaften des TÜV gehören, werden ihrerseits von staatlichen Einrichtungen überwacht. In etlichen Ländern, in denen es in früheren Jahren eher großzügig zuging, würden inzwischen strengere Regeln angewandt, sagt er.
"Diese Überwachungseinrichtungen nehmen nach unserem Eindruck ihre Aufgabe deutlich ernster wahr als noch vor geraumer Zeit."
Und der Geschäftsführer des Bundesverbands Medizintechnik, Joachim Schmitt, weist darauf hin, dass das Überwachungssystem bereits verschärft worden sei. Während früher bei den Herstellerfirmen nur nach Anmeldung kontrolliert wurde, kommen Prüfer der Benannten Stellen inzwischen auch immer wieder unangemeldet vorbei.
"Das heißt also, wir gehen davon aus, dass durch diese verstärkte Situation auch die entsprechenden Kontrollen korrekt durchgeführt werden."
Der Verband der deutschen TÜVs spricht sich für Veränderungen am bisherigen System aus, die zum Teil schon umgesetzt wurden, wie etwa die unangemeldeten Kontrollen. Grundlegende Reformen über diese Änderungen hinaus seien aber nicht nötig, heißt es in einem Positionspapier der TÜVs.
"Die vorgeschlagenen Nachjustierungen sind geeignet, einen signifikanten Beitrag zur Erhöhung der Sicherheit von Medizinprodukten für die Verbraucherinnen und Verbraucher in Europa zu leisten."
Joerg Hasford vom Arbeitskreis der Ethikkommissionen der Ärztekammern überzeugen solche Argumente nicht. Erst im vergangenen Dezember hätten Fernseh-Journalisten aus Holland erneut gezeigt, wie einfach es sei, ein CE-Prüfzertifikat zu erhalten.
"Da hat man so ein Netz, in dem Mandarinen verpackt sind, das Mandarinen-Label, -Etikett weggemacht, hat das viermal gefaltet, und hat es einer Benannten Stelle als sogenanntes Mesh, das ist ein Geflecht, das man zum Beispiel bei einer Bruchoperation einnäht in den Körper, und die haben dafür das CE-Kennzeichen bekommen. Für ein Mandarinen-Verkaufsnetz."
Forderungen nach einer europaweiten Kontrolle der Branche
Hasford fordert deswegen eine europaweite Kontrolle der Medizintechnikbranche durch unabhängige staatliche Stellen. Der Chef der AOK Bayern, Helmut Platzer, sieht das genauso. Die Erfahrungen mit der französischen Firma Poly Implant Prothèse, die zigtausende fehlerhafte Brustimplantate produziert hat, bis sie vor fünf Jahren aufflog, haben nach Ansicht des Kassenchefs gezeigt, dass das Kontrollsystem grundsätzlich anders organisiert werden muss.
"Französischer Hersteller kauft deutsches Industriesilikon, das europaweit, aber eben auch in deutschen Kliniken deutschen Frauen eingebaut worden ist. Er ist bei einem deutschen Versicherer versichert, allerdings bei dessen französischer Tochterfirma, und wird von einer deutschen Einrichtung zertifiziert, nach Regeln, bei dem man nicht genau zuordnen kann, ob die jetzt europäischen, französischen, oder deutschen Zertifizierungsstandards entsprechen. Ich glaube, das macht schon mal ganz deutlich, wo ein wesentlicher Teil des Problems ist."
Als der Brustimplantat-Skandal vor fünf Jahren öffentlich wurde, hieß es aus der Medizintechnik-Branche, wenn so viel kriminelle Energie im Spiel sei wie bei der französischen Firma PIP, dann stoße jede Kontrolle an ihre Grenzen. Das gilt nach Ansicht des Verbandsgeschäftsführers Joachim Schmitt heute noch - und zwar für private Kontrolleinrichtungen genauso wie für staatliche.
"Niemand kann Ihnen sagen, warum eine staatliche Stelle besser sein soll."
Und die Medizintechnikbranche sei ausgesprochen kleinteilig, erklärt Schmitt. In Deutschland gebe es rund 1.200 Firmen mit mehr als 20 Mitarbeitern, dazu kämen über 10.000 Kleinbetriebe - dazu passe das dezentrale Kontrollsystem der Benannten Stellen, nicht aber eine zentrale Überwachungsbehörde.
"Sie würden einen gigantischen Verwaltungsapparat aufbauen, wenn Sie eine europäische Zulassung für Medizinprodukte an einem Ort irgendwo erstellen würden."
Und Roland Prestel vom Großkonzern BBraun berichtet von Erfahrungen, die seine Firma mit der zentralen Kontrollbehörde in den Vereinigten Staaten gemacht hat. Dort dauere die Zulassung oftmals um ein Vielfaches länger als in Europa.
"Ich kenne aus der Vergangenheit viele Situationen, in denen bei uns ein Medizinprodukt zertifiziert wurde, dann in den Markt gegangen ist, und nach acht oder neun Jahren wieder aus dem Markt verschwunden ist, weil es ein neues, weiterentwickeltes Produkt gegeben hat, gleichzeitig aber zu diesem Zeitpunkt in den USA das identische Produkt den staatlichen Zulassungsprozess noch nicht final durchschritten hat."
Prestel räumt ein, dass das europäische Kontrollsystem zumindest in früheren Jahren Defizite hatte, wenn es darum ging, größtmögliche Sicherheit zu garantieren. Aber in der Summe hätten europäische Patienten damit mehr Vorteile als Patienten in den USA, glaubt er.
"Diese Chance, Medizinprodukte innerhalb eines gewissen überschaubaren Zeitraums auf den Markt bringen zu können, haben wir sicherlich mit diesem System."
Warnung vor naivem Fortschrittsdenken
Joerg Hasford hört bei seiner Arbeit an der Spitze der Ethikkommissionen der Ärztekammern solche Argumente immer wieder - er schüttelt darüber allerdings den Kopf. Er warnt vor naivem Fortschrittsdenken. Nicht alles, was neu ist, sei deshalb auch besser:
"Wir wissen das aus der Medizin sehr häufig: dass an sich plausibel wirkende Konzepte, auch technische Konzepte, wenn man sie dann beim Patienten einsetzt, diese Vorteile überhaupt nicht in eine verbesserte Lebensqualität oder eine verlängerte Überlebenszeit sich übersetzen lassen, sondern das technische Konzept mag brillant sein, aber es funktioniert im Menschen nicht."
Doch darüber, was den Patienten wirklich hilft, gebe es viel zu wenig Forschung, findet Hasford. Arzneimittelhersteller müssen inzwischen nicht nur nachweisen, dass neue Medikamente wirksam und weitgehend ungefährlich sind. Sie müssen auch belegen, dass sie Vorteile gegenüber anderen Präparaten bieten.
"Wenn wir das bei Medizinprodukten angucken, da gibt es nichts. Es muss nicht gezeigt werden, dass es wirksam ist und dass es einen patientenbezogenen Nutzen hat."
Roland Prestel vom Medizintechnik-Großkonzern BBraun sieht die Lage weniger pessimistisch. In einer Marktwirtschaft habe jede Firma ein Interesse daran, nachzuweisen, dass ihre Ware besser ist als die Ware der Konkurrenz, sagt er. Blockaden gegen eine Nutzenbewertung auch für Medizinprodukte, die sich die Bundesregierung im Koalitionsvertrag als Ziel gesetzt hat, erwartet er deshalb nicht.
"Wer es dann schafft, diesen sogenannten Zusatznutzen für sein Produkt, für seine Therapie nachzuweisen, der hat dann natürlich gut Lachen. Der hat die Chance, sein Produkt wesentlich besser zu platzieren."
Wann eine solche Nutzenbewertung tatsächlich kommt, ist aber offen. Und wenn man mit Vertretern der Medizintechnik-Industrie spricht, merkt man, dass sie auch gut damit leben können, wenn es keinerlei Verschärfungen gibt, weder bei Kontrollmaßnahmen für eine höhere Patientensicherheit, noch beim Nachweis, ob neue Techniken wirklich einen Nutzen bringen. Die Medizintechnikindustrie sei ganz aus sich heraus ausgesprochen innovativ, heißt es aus der Branche. Mit jährlich mehr als 10.000 Patentanmeldungen in Europa sei sie erfindungsreicher als jeder andere Wirtschaftszweig, erklärt der Branchenverband.
Und wer durch das Mannheimer "Technoseum" geht, merkt, dass Mediziningenieure gerne an Entwicklungen arbeiten, die heute noch als Science-Fiction erscheinen. Zu den Exponaten, die der Ausstellungsleiter Alexander Siegelen beschafft hat, gehört auch ein Schweineherz, aus dem wesentliche Zell-Bestandteile herausgelöst wurden. Übrig bleibt ein weiß schimmerndes Stützgerüst, das die Form eines Herzens hat.

"Die Idee ist tatsächlich, dieses Herz wieder mit Herzzellen, Muskelzellen zu besiedeln und auf diese Weise eben ein Herz im Bio-Reaktor herzustellen, das dann natürlich aus Stammzellen des Herzempfängers gezüchtet werden soll, sodass es dann auch nicht zu Abstoßungsreaktionen kommt. Aber hier steht die Forschung natürlich noch am Anfang, also das ist ein Projekt, was nicht in den nächsten zehn oder 20 Jahren wahrscheinlich abgeschlossen sein wird."
Bis dahin muss dann auch geklärt werden, ob ein auf diese Weise künstlich gezüchteter Herzmuskel überhaupt ein Medizinprodukt ist, und welche Regeln zum Patientenschutz hier greifen sollten. Aber auch wenn es so weit ist, werden andere Produkte den Medizin-Alltag weit stärker prägen: Knie- und Hüftprothesen, Herzschrittmacher oder Stents - bei denen stets aufs Neue entschieden werden muss, wie sich Chancen und Risiken in Einklang bringen lassen.