Der Feature-Autor hat vor kurzem auch ein Buch zum Thema veröffentlicht:
Matthias Eckoldt: "Virus. Partikel, Paranoia, Pandemie"
Ecowin, Elsbethen/ Österreich 2021
256 S., 20 Euro
Versuche, Zufälle und ein Skandal
Der Mediziner und Bakteriologe Robert Koch forschte nach unbekannten Krankheitserregern. © picture alliance / akg-images
Die Geschichte der Virenforschung
29:53 Minuten
Von Matthias Eckoldt · 20.01.2022
Zermürbende Misserfolge, dramatische Fehleinschätzungen, aber auch wissenschaftliche Sternstunden und ruhmversessene Datenmanipulation - das zeigt ein historischer Blick auf die Virenforschung. Und alles begann mit dem "Bazillenjäger" Robert Koch.
"Als ich den ehrenvollen Auftrag erhielt, einen der Vorträge für den Kongreß zu übernehmen, wurde ich vor die Wahl gestellt, das Thema für diesen Vortrag derjenigen Wissenschaft zu entnehmen, mit welcher ich mich jetzt vorzugsweise zu beschäftigen habe, nämlich der Hygiene, oder der Bakteriologie, welcher ich mich früher jahrelang fast ausschließlich widmen konnte. Ich habe mich für das letztere entschieden, weil ich annehme, daß die Bakteriologie noch immer das allseitigste Interesse beansprucht."
4. August 1890. 5000 Forscher aus 40 Ländern haben sich zum X. Internationalen Medizinischen Kongress in Berlin versammelt. In einem eigens für den Anlass umgebauten Zirkuszelt. Star in der Manege ist Robert Koch. Er trägt den Beinamen "Bazillenjäger", weil er als erster einen bakteriell verursachten Krankheitsprozess lückenlos nachverfolgen konnte. Seine Kollegen ermahnt Koch schließlich dazu, nach neuen Krankheitserregern Ausschau zu halten und gibt so den Startschuss für die Virenforschung.
Auf der Suche nach dem Krankheitserreger: Masern-Illustration in Meyers Konversationslexikon von 1897.© imago images / imagebroker
"Masern, Scharlach, Pocken, exanthematischer Typhus. Für keine einzige der Krankheiten ist es gelungen, nur den geringsten Anhaltspunkt dafür zu finden, welcher Art die Krankheitserreger derselben sein könnten. Ich möchte mich daher der Meinung zuneigen, dass es sich bei den genannten Krankheiten gar nicht um Bakterien, sondern um organisierte Krankheitserreger handelt, welche ganz anderen Gruppen von Mikroorganismen angehören."
Suche nach einer neuen Art von Krankheitserregern
"Und dann, wie so oft in der Geschichte der Wissenschaften, kam aus einer Ecke, die man nicht vermutet, der entscheidende Hinweis."
Herbert A. Neumann, bis zu seiner Pensionierung Chefarzt der Klinik für Innere Medizin im St. Elisabeth-Hospital Bochum und Autor des Buches "Die Entstehung der Virologie".
"Ende 19. Jahrhundert gab es in Holland – auch in Russland – Tabakpflanzer, die festgestellt haben, dass die Tabakpflanzen krank wurden."
Sie zeigten plötzlich mosaikartig angeordnete Flecken. Die Blätter wurden brüchig und verloren ihren charakteristischen Geschmack. Die Bauern der Provinzen Gelderland und Utrecht wenden sich in ihrer existenziellen Not an die Landwirtschaftliche Hochschule in Wageningen. Der deutsche Chemiker Adolf Eduard Mayer nimmt sich als Direktor dieser Einrichtung persönlich der Sache an.
Mayer presst Saft aus den kranken Blättern – der Fachbegriff dafür heißt homogenisieren. Doch unter dem Mikroskop zeigen sich keinerlei Auffälligkeiten im Vergleich zum Extrakt aus gesunden Pflanzen. Insofern weiß Mayer keinen rechten Rat für die Tabakpflanzer – außer jenem, die kranken Pflanzen auszureißen und zu verbrennen.
"Aber nachdem Mayer in Pension war, kam Beijerinck. Und Beijerinck hat dann einen entscheidenden Schritt über Mayer hinaus gemacht. Er hat ebenfalls homogenisiert und hat diese Flüssigkeit durch Chamberland-Filter gepresst, die Bakterien zurückgehalten haben. Und Beijerinck hat dann das Filtrat, das aus dem Filter rauskam, genommen und hat das auf junge gesunde Blätter gestrichen – und siehe da, sie wurden krank."
Beijerinck wählte die Bezeichnung "Virus"
Die Chamberland- ebenso wie die Berkefeld-Filter dienen im 19. Jahrhundert dazu, Bakterien aus infektiösen Lösungen zu extrahieren, um sie zu untersuchen. Vor Willem Beijerinck, um 1900 Mikrobiologe an der Technischen Hochschule in Delft, galt in der Mikrobiologie nur als wichtig, was im Filter hängen blieb. Das Filtrat selbst war nicht von Bedeutung.
"Man stellte eher als Zufallsbefund – und das ist ja bezeichnend für Wissenschaftsentwicklung – fest: Nein, gerade in dem Filtrat ist also ein infektiöses Agens."
Wilfried Witte ist Mediziner, Historiker und Autor des Buchs "Tollkirschen und Quarantäne". Zurzeit arbeitet er als Oberarzt für Anästhesiologie am Klinikum Bethel in Bielefeld.
"Und der entscheidende Punkt ist: Es ist offenkundig so klein, dass wir es nicht, wie wir es von der bakteriologischen Forschung gewohnt sind, sehen können im Lichtmikroskop, sondern wir sehen es gar nicht. Es ist, wie es hieß, ultravisibel und filtrierbar."
Beijerinck definiert den Auslöser der Tabakmosaikkrankheit als "contagium vivum fluidum": einen "lebenden, flüssigen Ansteckungsstoff".
Willem Beijerinck sucht einen Namen für diesen Ansteckungsstoff. Bakterien sind es offensichtlich nicht. Auch Pilze oder Bazillen können nicht die Ursache der Tabakmosaikkrankheit sein, da sie ebenfalls im Chamberland-Filter hängen geblieben wären. Schließlich wählt Beijerinck die Bezeichnung "Virus" für den unsichtbaren Erreger.
Erreger oder Gift?
Krankmachende Stoffe als Virus zu bezeichnen hat seit der Antike gute Tradition. Der römische Schriftsteller und Universalgelehrte Aulus Cornelius Celsus führt den Begriff im ersten Jahrhundert ein. Celsus hatte allerdings keinen konkreten Erreger im Sinn, als er von Virus sprach, sondern verwendete den Begriff im Sinne von: "Gift, Gestank, übler Schleim von Tieren und Pflanzen".
Handelt es sich vielleicht tatsächlich nur um ein Gift? Das Forscherduo Friedrich Löffler und Paul Frosch findet 1898 eine überzeugende Antwort auf diese Frage, sagt Herbert A. Neumann.
"Löffler und Frosch, beides Assistenten von Robert Koch in Berlin. Und die haben Tiere, die an Maul- und Klauenseuche litten, untersucht. Das ist eine Erkrankung, die mit Blasen im Maul einhergeht.
"Löffler und Frosch, beides Assistenten von Robert Koch in Berlin. Und die haben Tiere, die an Maul- und Klauenseuche litten, untersucht. Das ist eine Erkrankung, die mit Blasen im Maul einhergeht.
Und die haben diese Blasen punktiert und die Flüssigkeit, die sie da abpunktiert haben, auch filtriert. Und siehe da: Sie konnten mit diesem Filtrat diese Maul- und Klauenseuche auslösen. Und die haben damals schon richtig quantifiziert – zum Beispiel: Wie schwer ist so ein Kalb? Wie viel Flüssigkeit geben wir?
Löffler und Frosch stellen fest, dass ein Kalb von 200 Kilogramm bereits an Maul- und Klauenseuche erkrankt, wenn man ihm den fünftausendsten Teil eines einzigen Milliliters der infektiösen Lymphe spritzt – etwa ein Hundertstel eines einzigen Tropfens. In ihrer Studie schreiben die Forscher:
"Wenn sich 0,005 Milliliter im Körper des Tieres verteilen, würde man zu einem Giftwert von 1 zu 2,5 Trillionen gelangen. Eine derartige Giftwirkung wäre einfach unglaublich."
"Und die konnten dann rechnerisch nachweisen, dass es gar kein Gift sein kann, sondern es muss was anderes sein. Aber was, wussten sie eben auch noch nicht."
Allerdings hatten Löffler und Frosch nachgewiesen, dass Viren offenbar nicht nur bei Pflanzen, sondern auch bei Tieren ihr Unwesen treiben. Beim Menschen bringt die sogenannte Gelbfieber-Kommission Aufklärung.
Erforschung des Gelbfiebers
Die besonders in Süd- und Mittelamerika grassierende Krankheit geht mit Symptomen wie Übelkeit, Fieber, Erbrechen und Schmerzen einher. Bei tödlich verlaufenden Fällen wird die Leber stark geschädigt. Die dann einsetzende Gelbfärbung der Haut des Patienten gab der Krankheit ihren Namen.

Der Militärarzt Walter Reed leitete ein Forscherteam in Kuba zur Untersuchung von Gelbfieber.© picture alliance / akg-images
Gelbfieber ist zum Ende des 19. Jahrhunderts zu einer ernsten Bedrohung geworden: Der Bau des Panamakanals Anfang der 1890er-Jahre etwa muss unterbrochen werden, weil die Arbeiter reihenweise starben.
Bei der kriegerischen Auseinandersetzung zwischen Spanien und den USA in Kuba lassen im Jahr 1898 400 amerikanische Soldaten ihr Leben im Kampf – 5000 hingegen sterben an Gelbfieber. Grund genug also, ein Forscherteam unter der Leitung des Militärarztes Walter Reed nach Kuba zu schicken, das mit vollem Einsatz ans Werk geht:
"Die haben Mageninhalt von Patienten geschluckt, um zu gucken, ob das krank macht. Das ist nicht passiert. Die Patienten wurden in Pyjamas und Bettdecken gesteckt, in denen Leute an Gelbfieber gestorben sind. Und sie wurden nicht infiziert.
Bis dann schließlich über Expositionsversuche mit der Aedes Aegypti – also dieser Mücke – das nachgewiesen werden konnte. Man hat also dann diese Mücke Blut saugen lassen von Patienten, die dieses Gelbfieber hatten und hat dann gesunde Leute damit infiziert."
Der US-amerikanische Arzt Jesse Lazear kümmert sich in der Gelbfieberkommission um die Mücken. Er zieht sie auf und verwahrt sie in Reagenzgläsern, damit sie nichts anderes als Blut von Gelbfieberpatienten zu sich nehmen. Er erklärt sich zu einem Selbstversuch bereit, lässt sich stechen und steckt sich an. Nach zwei qualvollen Wochen fällt er ins Delirium und stirbt im Alter von 34 Jahren.
"Das Problem war, dass man erst herausfinden musste, dass zwischen dem Stich und dem Saugen des erkrankten Blutes und der Infektiosität 14 Tage vergehen mussten, bis im Körper dieser Mücke das Virus sich vermehrt hatte. Und damit war die Sache klar."
Dass es ein Virus ist, das Jesse Lazear umgebracht hat, ergibt sich wiederum aus Filtrationsversuchen. Die von Beijerinck erfundene Methode wird zu einer Art Goldstandard der frühen Virenforschung:
Bei allen Infektionen, die nicht auf einen bakteriellen Erreger zurückgeführt werden können, wird krankmachendes Material isoliert, durch bakteriendichte Filter gepresst und danach geprüft, ob das Filtrat wiederum ansteckend ist.
Boom in der Virenforschung
Dank der Beijerinck-Methode erlebt die Virenforschung Anfang des 20. Jahrhunderts ihren ersten Boom. Immer neue Viren werden identifiziert: 1903 das Tollwutvirus, 1905 gelingt der Nachweis des Pockenvirus. 1907 kann der Erreger des Denguefiebers nach den Regeln der herrschenden mikrobiologischen Kunst dingfest gemacht werden.
Das Virus der Kinderlähmung folgt 1909, zwei Jahre später der Erreger der Kaninchenpest, ebenfalls 1911 das Masernvirus. Im Jahr darauf folgen das Herpes- und 1916 das Mumpsvirus. 1917 findet man Viren, die Bakterien auffressen und die daher Bakteriophagen genannt werden. Aber: noch immer hat niemand auf der Welt ein Virus zu Gesicht bekommen.
Zum Ende des Ersten Weltkrieges löst ein Virus dann die bislang schwerste Pandemie in der Menschheitsgeschichte aus, die in mehreren Wellen über den Planeten rast. Die Krankheit beginnt plötzlich mit Gliederschmerzen und Mattigkeit. Rasch kommen Husten und Halsschmerzen hinzu, es folgt hohes Fieber, zugleich sinkt die Herzfrequenz ab.
Die resultierende Unterversorgung der Haut führt zu einer dunkel-violetten Verfärbung, die Betroffene und Ärzte vielerorts zuerst an die Pest denken lässt. Auf der übel heimgesuchten indonesischen Insel Java soll der Krankheitsverlauf vom Volksmund so auf den Punkt gebracht worden sein: "Morgens krank, abends tot" oder: "Abends krank, morgens tot."
Auch im Deutschen Reich explodieren die Fallzahlen. Der Regierungspräsident von Breslau berichtet von den Ereignissen in seinem Verwaltungsdistrikt:
"Kaum eine Familie blieb von der Krankheit verschont; in sehr vielen wurden alle Mitglieder von der Seuche ergriffen. In den Städten leerten sich die Fabriken, die Büros der Behörden, die Geschäfte und die Schulen, und das Vieh musste hungern, weil alles krank und arbeitsunfähig darniederlag."
Die Spanische Grippe als Prototyp der Pandemie
In Berlin bricht das Gesundheitssystem unter dem Ansturm der Kranken zusammen. Ab Anfang Oktober 1918 kann im Westend-Krankenhaus nur noch auf Behandlung hoffen, wer mindestens 41 Grad Fieber vorweisen kann.
"Damit ist die Spanische Grippe zum Prototypen einer desaströsen Pandemie geworden. Von daher stellte sich gleich im selben Moment die Frage: Wenn wir das jetzt also mal ein bisschen mehr zur Kenntnis nehmen, was für ein großes Ereignis das gewesen ist, dass es bis zu 50 Millionen Tote gegeben haben muss: Wo kommt das eigentlich her?
In der Zeit war die Spanische Grippe etwas, womit keiner gerechnet hatte. Man sprach ja im Deutschen erstmal von rätselhafter Krankheit. Sie war rätselhaft und hatte etwas, was nicht richtig greifbar war", sagt Wilfried Witte.
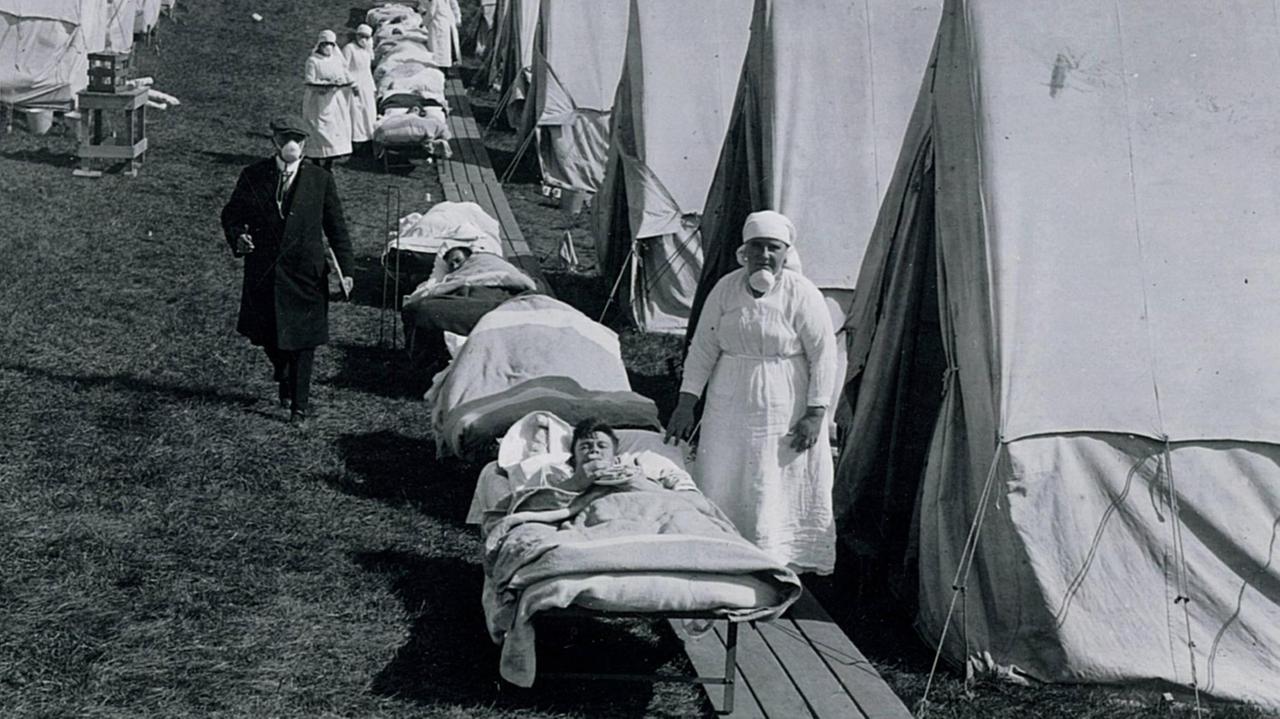
Eine Schwester und mit Infizierten in einem Notlazarett: Die Spanischen Grippe forderte weltweit viele Todesopfer.© picture-alliance / akg-images
Das vor allem, weil der Erreger nicht gefunden wird. Und die Virologie steht sich dabei selbst im Weg: Denn obwohl das Fach im institutionellen Sinne zu der Zeit noch gar nicht eigenständig existiert, wird die Suche nach dem Grippevirus bereits durch eine Lehrbuchmeinung behindert.
Lehrbuchmeinung behindert Fortschritt
1892 hatte der deutsche Mediziner Richard Pfeiffer am Ende der sogenannten Russischen Grippe den mutmaßlichen Erreger in den Nasen grippeinfizierter Patienten entdeckt: Ein Bakterium, das er "Bacillus influenzae" nannte. In die Lehrbücher geht der Erreger als "Pfeiffers Bacillus" oder "Haemophilus influenzae" ein.
Das Bakterium wird auch während der Spanischen Grippe bei vielen Patienten gefunden. Aber: nicht bei allen. Damit ist eigentlich bewiesen, dass Haemophilus influenzae nicht der Auslöser der Grippe sein konnte. Doch gegen Pfeiffers Lehrbuchmeinung, die international als verbindlich gilt, kommt kein Befund an.
"Letzten Endes gab es in Deutschland so eine Art Showdown. Und zwar als sich am 9.9.1920 die deutschen Virologen trafen und fachpolitisch entschieden wurde: Was ist denn jetzt das, wovon wir ausgehen? Und da hat sich Pfeiffer durchgesetzt. Das ist aber auch der Grund, warum die deutsche Mikrobiologie dann bis in die 1950er-Jahre letztlich den Anschluss verlor an die weiteren virologischen Entwicklungen."
Zumindest was die Grippeforschung angeht. Das Grippevirus wird schließlich 1933 in Großbritannien von den Virologen Christopher Andrewes und Wilson Smith isoliert und in Infektionsversuchen auf Frettchen übertragen. Sie gelten seither als Modellorganismus für die Influenzaforschung.
Elektronenmikroskopie bringt neue Einsichten
Zugleich aber ist es deutsche Ingenieurskunst, die die Virologie ein beträchtliches Stück voranbringt: als die Elektrotechniker Max Knoll und Ernst Ruska 1931 das Elektronenmikroskop erfinden. Das Gerät verspricht mit einer 30.000-fachen Vergrößerung Einblicke in den Bereich deutlich unterhalb der Bakterien.
Allerdings sausen im Inneren Elektronen mit halber Lichtgeschwindigkeit durchs Vakuum. Abgegeben von einer Glühkathode und beschleunigt durch eine Spannung von 80.000 Volt. Das, so Wilfried Witte, hört sich nicht nach einem Ort an, an dem organische Substanzen Bestand haben würden.
"Das ist auch wieder so ein Punkt. Was mache ich, indem ich das Elektronenmikroskop anwende, mit dem, was ich da sehe? Die Hitzeentwicklung kann ja auch dazu führen, dass ich die Substanz beschädige oder verändere."
Glücklicherweise hat Ernst Ruska einen jüngeren Bruder: Helmut Ruska, Mediziner, hatte es sich in den Kopf gesetzt, als erster Mensch ein Virus sehen zu können.
Der Durchbruch bahnt sich an, als Helmut Ruska seine Präparate mit einer äußerst dünnen Haut eines Speziallacks überzieht und seine Objekte mit dem Platinmetall Osmium räuchert. Auf diese Weise gelingt es ihm 1938, Tabakmosaikviren auf einen Trägerfilm zu bannen und im Elektronenmikroskop darzustellen.

Die Elektrotechniker Max Knoll und Ernst Ruska erfanden 1931 das Elektronenmikroskop.© picture-alliance / akg-images
"Das war eine tolle Leistung, die natürlich für die Virologie fantastisch war, weil man dann auch die Form, die Größe, die ganze Architektur sehr genau darstellen konnte. Da gibt es phantastische Fotos von Ruska, wie richtig das Virus auf der Zelle sitzt und sich durchbohrt und die Zelle dann infiziert und in der Zelle dann sich vermehrt", sagt Herbert A. Neumann.
Partikel, die Zellen befallen
Damit ist bewiesen, dass es sich bei Viren weder um ein Gift, noch um eine flüssige Substanz handelt. Man hat es stattdessen mit Partikeln zu tun, die Zellen befallen, um sich von ihnen vermehren zu lassen.
Außerhalb von Hitler-Deutschland bekommt man jedoch nichts mit von Ruskas bahnbrechenden Arbeiten. Der US-amerikanische Biophysiker Thomas Anderson müht sich an der Universität von Pennsylvania noch Anfang der 1940er-Jahre vergeblich mit der Darstellung von Viren ab, während Ruska bereits mehr als 20 Publikationen über seine neue Art der Bildgebung veröffentlicht hatte.
Anderson schreibt rückblickend: "Als ich 1940 das erste Mal von dem Elektronenmikroskop hörte, von dem man sagte, dass es in Deutschland entwickelt worden sei, schien es mir fast, als ob dies ein Streich der Nazis gegen den Rest der Welt sei."
"Es kam die neue Technik", sagt Wilfried Witte. "Es gab die Möglichkeit etwas sichtbar zu machen. Aber auch Ruska selbst hat gesagt: Damit haben wir immer noch nicht eine nähere Bestimmung des Virusbegriffes, sondern das ist immer noch eine Kollektivbezeichnung von Substanzen, die offensichtlich sehr unterschiedlich zu sein scheinen.
Das heißt, nur die Sichtbarmachung macht keine Aussage über das Wesen des Virus. Da braucht man dann schon noch – vereinfacht gesagt – die Genetik."
Genetiker erforschen das Wesen der Viren
Bei den ersten Experimenten zur Genetik werden die Virologen erneut durch die selbstverschuldete Isolation Deutschlands behindert. Im englischsprachigen Raum geht man davon aus, dass Viren zum größten Teil aus Eiweiß bestehen.
Bei chemischen Analysen finden sich jedoch auch etwa 10 Prozent Ribonukleinsäuren im Virenmaterial, die allerdings von der Scientific Community zumeist als bedeutungslos angesehen werden.
"Bis Gerhard Schramm, der damals am Kaiser-Wilhelm-Institut gearbeitet hat am Tabakmosaikvirus, ein geniales Experiment gemacht hat. Er konnte den Eiweiß-Anteil vom Ribonukleinsäure-Anteil trennen über einen Trick – über ph-Inkubation – und konnte feststellen, dass der Eiweißanteil nicht infiziert.
Aber der RNS-Anteil, der infiziert. Damit war eigentlich klar, dass die RNA die entscheidende krankmachende Substanz war", sagt Herbert A. Neumann.
"Außerhalb Deutschlands hielt praktisch niemand die Schramm’schen Ergebnisse für richtig. Für die meisten war es unfassbar, dass die deutschen Bestien in den letzten Jahren des Krieges die ordnungsgemäße Durchführung der umfangreichen Experimente zugelassen haben sollten, die Schramms Behauptungen zugrunde lagen."
Schreibt der Molekularbiologe James Watson, der in den 1950er Jahren gemeinsam mit dem Physiker Francis Crick die Doppelhelixstruktur der DNA aufklärt. 1962 bekommen die Beiden für ihre molekulare Analyse der Erbinformationen den Nobelpreis.
Viren durchbrechen Dogma der Molekularbiologie
Francis Crick stellt 1958 das von ihm sogenannte zentrale Dogma der Molekularbiologie auf. Demzufolge verläuft der Informationsfluss immer von den in Form von DNA gespeicherten Erbinformationen im Kern lebendiger Zellen zur RNA, die den Bauplan der Eiweiße im nächsten Schritt zu den Proteinfabriken bringt, wo dann die benötigten Stoffe hergestellt werden.
DNA wird zu RNA wird zu Protein – das gilt für alle biologischen Strukturen. Nur für Viren nicht unbedingt. Rasch stellt sich heraus, dass sich Viren anders verhalten als alles, was man bis dahin aus der Biologie kannte. Und zwar in mehrfacher Hinsicht:
Viren vermehren sich nicht durch Teilung, können im Gegensatz zu allen übrigen Mikroorganismen nicht wachsen und verfügen nicht einmal über einen eigenen Stoffwechsel. Alle notwendige Energie für ihre Synthese wird nicht von ihnen selbst, sondern von der Wirtszelle geliefert. Somit erfüllen Viren keines der geläufigen Kriterien, die Biologen für das Leben aufgestellt hatten. Bis heute werden Viren deshalb auch als lebensnahe Existenzformen bezeichnet.
Bis Ende der 1960er-Jahre sind zwei Sorten von Viren bekannt: Jene, die ihr Erbgut in Form von DNA organisieren und andere, die die Informationen über ihre Nachkommen in der RNA abspeichern, das Dengue- oder das Gelbfieber-Virus zum Beispiel - oder auch das SARS-CoV2-Virus.
RNA-Viren lassen nach Zelleintritt die für ihre Nachkommen benötigten Eiweiße direkt aus ihrer RNA heraus produzieren, ohne in den Zellkern einzudringen, wo die DNA sitzt. Wenig später jedoch findet man auch RNA-Viren, die einen geradezu kuriosen Umweg gehen.

Viren können aus RNA DNA synthetisieren - daran forschte auch Karin Mölling, bis zu ihrer Emeritierung Direktorin des Instituts für medizinische Virologie in Zürich.© picture-alliance/ Keystone / Steffen Schmidt
Karin Mölling, Autorin von "Viren. Supermacht des Lebens" und bis zu ihrer Emeritierung Direktorin des Instituts für medizinische Virologie in Zürich: "Als ich aus Amerika zurückkam 1969 und in Tübingen meine Doktorarbeit anfing, ging es um die Frage, wie sich diese Viren vermehren.
Sie enthalten RNA und jeder normale Molekularbiologe würde jetzt sagen: Um RNA in RNA für die Nachkommen umzuwandeln, braucht man eine RNA-Verdopplungsmaschinerie. Das versuchte ich ein halbes Jahr und kam und kam damit nicht zurecht. Und dann hörte ich, es gäbe da einen Forscher in Amerika, Howard Temin, und der hätte gefunden, dass die RNA sich in DNA umwandeln lässt."
1970 erscheinen in der Fachzeitschrift Nature gleich zwei Beiträge, die eine bis dahin völlig unbekannte Interaktion von Virus und Wirtszelle vorstellen. Die US-amerikanischen Virologen Howard Temin und David Baltimore hatten unabhängig voneinander ein Enzym entdeckt, das sie RNA-abhängige DNA-Polymerase nannten.
Dieses Enzym ermöglicht es bestimmten Viren, ihre RNA in DNA umzuschreiben, sobald sie in eine Zelle eingedrungen sind. Auf diese Weise kann ihre so erzeugte DNA in die Erbinformation im Kern der Wirtszelle eingebaut werden. So entert das Virus die Befehlszentrale der Zelle und lässt sie seine Nachkommen produzieren, bis der Wirt kollabiert.
"Alles, was ich ändern musste, waren die Bausteine für die Synthese. Die RNA-Synthese musste in DNA-Synthese übersetzt werden. So, ich nahm ein wenig von dem Virus und die Bausteine für die Synthese, und was trat ein?
Der Zähler hatte einen Vollausschlag, so viel Synthese von DNA war zustande gekommen. Und es gab einen kleinen Auflauf am Zähler: So viel DNA-Synthese hat es noch nie gegeben. Jetzt war also gezeigt, diese Viren können aus RNA DNA synthetisieren", sagt Karin Mölling.
Viren dringen in die DNA
Das grenzt an eine Sensation. Kein anderer Mikro- und auch kein Makroorganismus kann RNA in DNA verwandeln. Bestimmten Viren gelingt das. Aber: Was war dann mit dem erst ein Jahrzehnt zuvor aufgestellten Dogma der Molekularbiologie, das vorschreibt, in welche Richtung der Informationsfluss läuft – immer von der DNA zur RNA zum Protein?
Die Logik verkehrt sich: Das Dogma spricht nicht gegen die Entdeckung von Temin und Baltimore, sondern eben diese Entdeckung führt das Dogma ad absurdum! Francis Crick korrigiert es ein paar Jahre später.
Für das Enzym findet sich schon bald der treffende Name: "Reverse Transkriptase". Er bezeichnet die Fähigkeit, den geläufigen Weg der Biosynthese umzukehren und einen reversen Effekt bei der Transkription der Erbinformation hervorzubringen. Die Erreger, die sich der reversen Transkriptase bedienen, werden Retroviren genannt.

Verursachte einen Skandal: der Virenforscher Robert Gallo, aufgenommen im Jahr 1981 bei einem Aids-Symposium in der Schweiz.© imago/ZUMA Press
"Den meisten sind die Retroviren bekannt durch das Humane Immundefizienzvirus HIV, das zur AIDS-Erkrankung führt. Das ist seine traurige Berühmtheit. Denn wir alle wissen, wie viele Menschen an dieser Erkrankung verstorben sind und die Krankheit ist ja noch nicht zum Stillstand gekommen."
In den 1980er-Jahren treten zwei Forscher mit ihren Arbeitsgruppen an, um dem Erreger auf die Spur zu kommen, der seit Frühjahr 1981 zuerst in der Homosexuellenszene von Los Angeles und wenig später weltweit für Angst und Schrecken sorgt. In Paris forscht Luc Montagnier und im US-amerikanischen Maryland Robert – Bob – Gallo.
HI-Viren: einer der ersten Skandale in der Virenforschung
Robert Gallo hatte die ersten beiden Retroviren beim Menschen gefunden. 1979 das Humane T-Zell-Leukämie-Virus, kurz: HTLV-1, 1981 dann das Haarzell-Leukämie-Virus HTLV-2.
"Ich habe mich auf die Art von Viren konzentriert, die ich bislang erforscht hatte. Die Leukämie-Retroviren. Wir erwarteten beim AIDS-Erreger ein ähnliches Virus zu finden und verfolgten von Anfang an die These, dass das Leukämie- und das AIDS-Virus in dieselbe Kategorie gehörten. Diese Überlegung ließ mich 1982 mit der Erforschung von AIDS starten."
Die Forschergruppen wissen, wonach sie suchen mussten: Würden sie Reverse Transkriptase finden, wäre das ein erstes starkes Indiz für ein Retrovirus. Doch die Suche bleibt erfolglos, bis Anfang 1983 im Pariser Labor die Gewebeprobe eines jungen homosexuellen Patienten eintrifft.
Als der Test auf Reverse Transkriptase ein positives Resultat zeigt, ist bewiesen, dass es sich tatsächlich um ein Retrovirus handelt.

Entdecker des AIDS-Virus: der französische Virologe Luc Montagnier, aufgenommen im Jahr 1986.© picture-alliance / akg-images / Paul Almasy
Montagnier gibt ihm die Bezeichnung LAV. Allerdings schafft er es nicht, das Virus zu vermehren, um weitere labortechnische Untersuchungen durchführen zu können. Daraufhin schickt er die Probe nach Maryland zu Bob Gallo.
In Gallos Labor gelingt es, unter anderem durch die Verwendung menschlicher Lymphozyten aus dem Nabelschnurblut eines Neugeborenen, das Virus zu kultivieren und in Massen herzustellen. Mit Hochdruck arbeitet Gallo nun an einem Antikörpertest. Als der zuverlässig funktioniert, tritt er zusammen mit der US-amerikanischen Gesundheitsministerin vor die Presse und verkündet, dass er das AIDS-auslösende Virus gefunden hat.
Er nannte es HTLV-3 und verschweigt die Entdeckung seines Kollegen Montagnier. Doch das rächt sich. Denn rasch stellt sich heraus, dass sein Erreger und das von Montagnier identifizierte Virus von derselben Art waren. Ein wissenschaftlicher Skandal.
Karin Mölling verfolgt ihn damals hautnah und schreibt: "Proteste führten dazu, dass Gallo zugab, seine Laborantin habe da etwas verwechselt. Gallo hatte das Virus von Montagnier mit seinen Viren gemischt und gehofft, das würde keiner merken.
Bei jedem bis dahin bekannten Virustyp wäre der Betrug nicht herausgekommen. HIV jedoch verändert sich rasend schnell. Und Gallos Viren – wären sie denn unabhängig gewesen – hätten niemals identisch mit denen aus Paris sein können." Der Nobelpreis für die Entdeckung des HI-Virus geht 2008 an Luc Montagnier.
Viren als Treiber der Evolution
Standen im 19. und 20. Jahrhundert Viren vor allem als Krankheitserreger im Fokus der Forschung – so weitet sich der Blick seit einigen Jahren. Die geradezu virtuosen Vermehrungsstrategien von RNA-Viren etwa gaben Anlass zur Hypothese, dass es diese Art Viren schon einige hundert Millionen Jahre vor den ersten Lebewesen gegeben haben könnte. Dass sie die gesamte Evolution angestoßen haben könnten.
Der noch junge Zweig der Paläo-Virologie hat zuletzt noch eine weitere verblüffende Dimension ans Licht gebracht. Demnach verdanken wir höheren Säugetiere den Viren vielleicht sogar unsere Existenz.
"Wenn eine Frau schwanger wird, hat sie einen Embryo, der eigentlich als fremd erkannt werden müsste. Damit würde sich das Immunsystem der Mutter gegen den eigenen Embryo entwickeln müssen und könnte ihn abstoßen. Da sind die Retroviren davor."
Von den Retroviren weiß man, wie raffiniert sie sich im Zellkern festsetzen und von Zellgeneration zu Zellgeneration vererben lassen können. Die Gene des HI-Virus beispielsweise schlummern bis zu 15 Jahre im Erbgut des Wirtes.
Einige Retroviren kommen noch einen Schritt weiter und können ihr Erbgut nicht nur in menschliche Körperzellen, sondern in die Kerne der Keimzellen einbauen. So sieht ideale Anpassung aus, denn nun muss das Virus seinen Wirt gar nicht mehr krankmachen, um für seine Nachkommenschaft zu sorgen. Die Virusgene stehen für neue Aufgaben im Genom des Organismus bereit.
Eines dieser Gene sorgt etwa für die Herstellung bestimmter Eiweiße, die einst die Hülle eines Virus mit der Membran der Wirtszelle verbanden. Sie finden sich heute in der Plazenta des Menschen und sorgen für eine Verringerung der Immunantwort in dieser Region.
"Dieser Vorgang ist von einem Virus vor vielen Millionen Jahren – 85 Millionen Jahren – entstanden", sagt Karin Mölling. "Und deswegen müssen wir keinen Kängurubeutel haben, der das Immunsystem von dem Muttertier durch den Kängurubeutel abtrennt oder auch keine Eierschale mehr benutzen. Das ist also ein evolutionärer Vorteil, den wir diesen Viren verdanken."
Das Feature ist eine Wiederholung vom 06.05.2021.