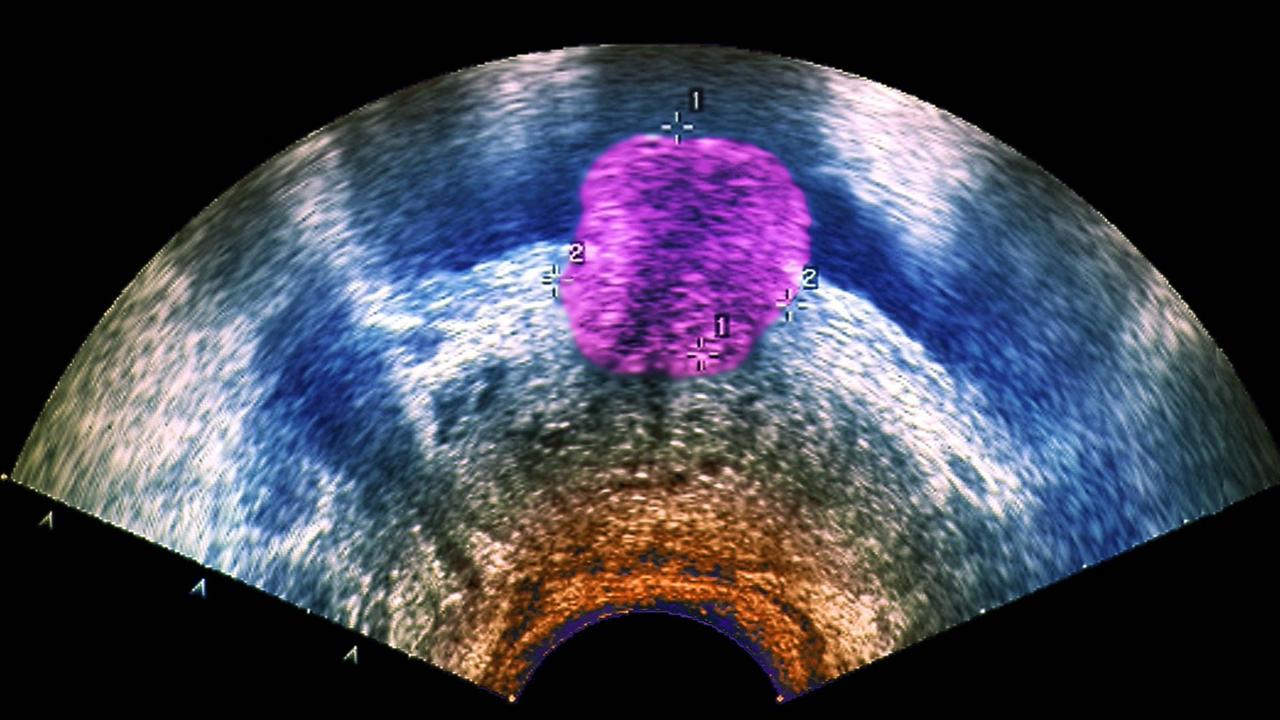
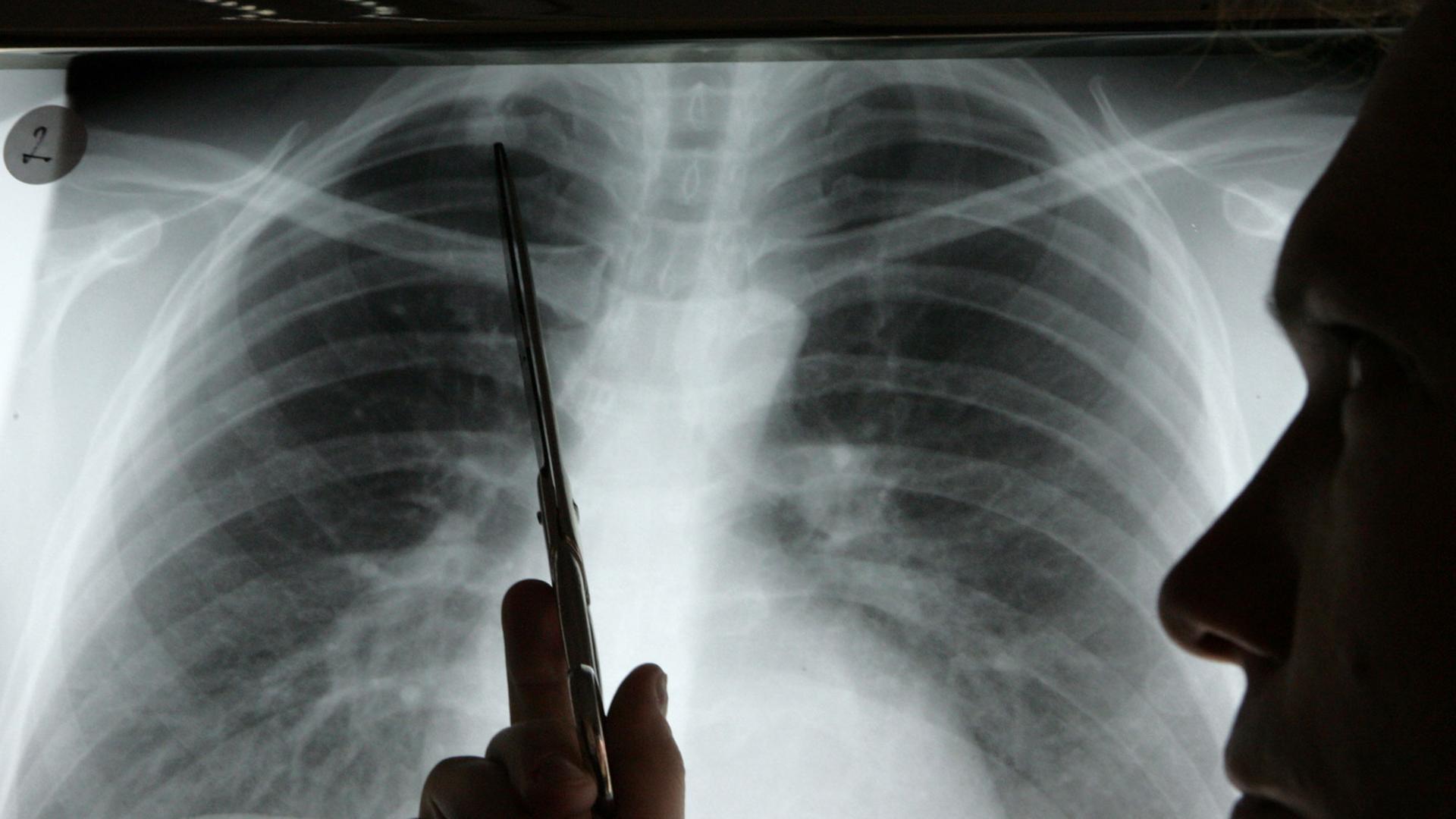
Moderne Krebsmedikamente zielen meist nicht mehr auf bestimmte Tumorarten wie Brustkrebs oder Prostatakarzinom. Sie setzen jeweils an einzelnen genetischen Veränderungen an, die in ganz unterschiedlichen Krebsformen auftreten können. Bevor die Ärzte sie anwenden, testen sie deshalb den Tumor auf diese Mutationen. Aber so ein einzelner Test reicht oft nicht aus.
"Also die Signalwege in den unterschiedlichen Tumorzellen, die sind miteinander quer verschaltet, und deswegen kann es sein, dass man eine sehr präzise gerichtete Therapie für eine Tumorart anwenden kann. Die gleiche Mutation führt bei einem anderen Tumor überhaupt nicht zu einem gewünschten Effekt."
"Also die Signalwege in den unterschiedlichen Tumorzellen, die sind miteinander quer verschaltet, und deswegen kann es sein, dass man eine sehr präzise gerichtete Therapie für eine Tumorart anwenden kann. Die gleiche Mutation führt bei einem anderen Tumor überhaupt nicht zu einem gewünschten Effekt."
Komplexität der Krebsherde analysieren
Der Tumorimmunologe Sebastian Ochsenreither von der Berliner Charité will deshalb die ganze Komplexität der Krebsherde seiner Patienten analysieren. Dazu dient ein virtuelles Gegenstück des Kranken, der sogenannte "digitale Zwilling", der je nach Tumorart am Deutschen Krebsforschungszentrum in Heidelberg oder dem Berliner Max-Planck Institut für molekulare Genetik erstellt wird.
"Der Term 'digitaler Zwilling' ist sehr schön, aber das ist nicht ein ganzes Modell eines Menschen."
Schränkt die Berliner Genetikerin Marie-Laure Yaspo gleich ein. Im virtuellen Raum wird vorerst nur der Tumor nachgebildet. Und zwar als mathematisches Modell. Mehr als 22.0000 Gleichungen fassen darin das ganze biochemische und genetische Wissen zu Krebszellen zusammen.
"Der Term 'digitaler Zwilling' ist sehr schön, aber das ist nicht ein ganzes Modell eines Menschen."
Schränkt die Berliner Genetikerin Marie-Laure Yaspo gleich ein. Im virtuellen Raum wird vorerst nur der Tumor nachgebildet. Und zwar als mathematisches Modell. Mehr als 22.0000 Gleichungen fassen darin das ganze biochemische und genetische Wissen zu Krebszellen zusammen.
Entscheidend ist, diesen allgemeinen virtuellen Homunculus an den individuellen Patienten anzupassen. Deshalb extrahiert Marie-Laure Yaspo erst einmal das komplette Erbgut des Tumors.
"Von der DNA Sequenz wir können die Mutationen lesen, aber auch die Chromosomenveränderungen."
Manchmal findet sich nur eine relevante Mutation, aber oft sind gleich mehrere Signalwege gestört. Zusätzlich bestimmten die Berliner Forscher auch die Aktivität hunderter Gene.
"Von der DNA Sequenz wir können die Mutationen lesen, aber auch die Chromosomenveränderungen."
Manchmal findet sich nur eine relevante Mutation, aber oft sind gleich mehrere Signalwege gestört. Zusätzlich bestimmten die Berliner Forscher auch die Aktivität hunderter Gene.
"Das ist auch der Unterschied zu vielen anderen Projekten, weil das liefert eine große Menge von Informationen, die sind sehr, sehr wichtig."
Mutationen suchen und virtuell Medikamente testen
Ein Wust an Daten, der in das das mathematische Modell übertragen wird. So entsteht aus dem allgemeinen Modell eine digitale Kopie genau dieses Tumors. Im nächsten Schritt wird simuliert, ob und wie Medikamente in diesem Umfeld wirken. Auf dem Bildschirm erscheint eine lange Liste: Für jedes Krebsmedikament wird hier der wahrscheinliche Effekt abgeschätzt. Klickt man auf einen vielversprechenden Wirkstoff, erscheint der dazugehörige Signalweg, ein Gewirr von Knoten und Pfeilen.
"Dann kriegen wir eine Karte vom Netzwerk mit diesen Punkten, wo die Probleme sind, und das Modell macht eine Kalkulation, welches Medikament würde am besten passen in dieser Zusammensetzung von Änderung. Das ist, wo das Modell wirklich einen Vorteil hat."
Daran kann man zum Beispiel sehen, welche zusätzlichen Wirkstoffe Erfolg versprechen. Sechs bis acht Wochen braucht es, bis die Ergebnisse vorliegen, bis klar ist, welche Mutationen in diesem konkreten Fall das Tumorwachstum wirklich antreiben. Dann sind wieder Sebastian Ochsenreither und seine Kollegen an der Reihe. In großen Datenbanken suchen sie nach Zellkulturdaten, Tierexperimenten oder klinischen Studien zu genau diesen Mutationen. In Berlin hat die digitale Tumorkopie in einigen Fällen entscheidende Impulse für die Therapie gegeben: So wies das Modell bei einer Patientin auf eine seltene Mutation hin, an der ein brandneues Medikament ansetzt.
"Diese Mutation haben wir nur gefunden, weil wir sie komplett sequenziert haben. Und diese Patientin hat innerhalb von einer Woche 90 Prozent ihrer Tumorlast verloren. Das ist etwas, das hat uns sehr überrascht."
"Dann kriegen wir eine Karte vom Netzwerk mit diesen Punkten, wo die Probleme sind, und das Modell macht eine Kalkulation, welches Medikament würde am besten passen in dieser Zusammensetzung von Änderung. Das ist, wo das Modell wirklich einen Vorteil hat."
Daran kann man zum Beispiel sehen, welche zusätzlichen Wirkstoffe Erfolg versprechen. Sechs bis acht Wochen braucht es, bis die Ergebnisse vorliegen, bis klar ist, welche Mutationen in diesem konkreten Fall das Tumorwachstum wirklich antreiben. Dann sind wieder Sebastian Ochsenreither und seine Kollegen an der Reihe. In großen Datenbanken suchen sie nach Zellkulturdaten, Tierexperimenten oder klinischen Studien zu genau diesen Mutationen. In Berlin hat die digitale Tumorkopie in einigen Fällen entscheidende Impulse für die Therapie gegeben: So wies das Modell bei einer Patientin auf eine seltene Mutation hin, an der ein brandneues Medikament ansetzt.
"Diese Mutation haben wir nur gefunden, weil wir sie komplett sequenziert haben. Und diese Patientin hat innerhalb von einer Woche 90 Prozent ihrer Tumorlast verloren. Das ist etwas, das hat uns sehr überrascht."
Mit digitalen Tumoren Zusammenhänge identifizieren
Bislang wurde in Deutschland für rund 80 Patienten eine digitale Kopie ihres Tumors erstellt. Bei etwa der Hälfte ergaben sich neue Hinweise für die Ärzte, die aber nicht immer zu so dramatischen Erfolgen führten. Bei der anderen Hälfte der Patienten lief die aufwändige Analyse aber letztlich ins Leere. Es handelt sich noch um eine sehr experimentelle Methode, gerade beginnen die Genetiker und Ärzte zu verstehen, bei welchen Tumoren sie tatsächlich weiterführt.
"Ich denke nicht, dass wir in drei Jahren einfach jeden Patienten mit Krebs einmal sequenzieren. Das ist auch nicht zielführend."
Entscheidend ist, dass die digitalen Zwillinge aus Berlin helfen, neue Zusammenhänge zwischen Tumormutationen und Medikamenten zu identifizieren. Sie kommen letztlich allen Kliniken und allen Patienten zugute, weil sie jetzt in den Datenbanken gut aufbereitet zu finden sind.
"Der Kollege, der das im letzten Jahr gemacht hat, der hat da über 1.000 Einträge hinterlassen in dieser Datenbank. Einfach, weil er den ganzen Tag nach wissenschaftlichen Daten zu Mutation gesucht hat, die wir selber hier bei unseren Patienten gefunden haben."
"Ich denke nicht, dass wir in drei Jahren einfach jeden Patienten mit Krebs einmal sequenzieren. Das ist auch nicht zielführend."
Entscheidend ist, dass die digitalen Zwillinge aus Berlin helfen, neue Zusammenhänge zwischen Tumormutationen und Medikamenten zu identifizieren. Sie kommen letztlich allen Kliniken und allen Patienten zugute, weil sie jetzt in den Datenbanken gut aufbereitet zu finden sind.
"Der Kollege, der das im letzten Jahr gemacht hat, der hat da über 1.000 Einträge hinterlassen in dieser Datenbank. Einfach, weil er den ganzen Tag nach wissenschaftlichen Daten zu Mutation gesucht hat, die wir selber hier bei unseren Patienten gefunden haben."