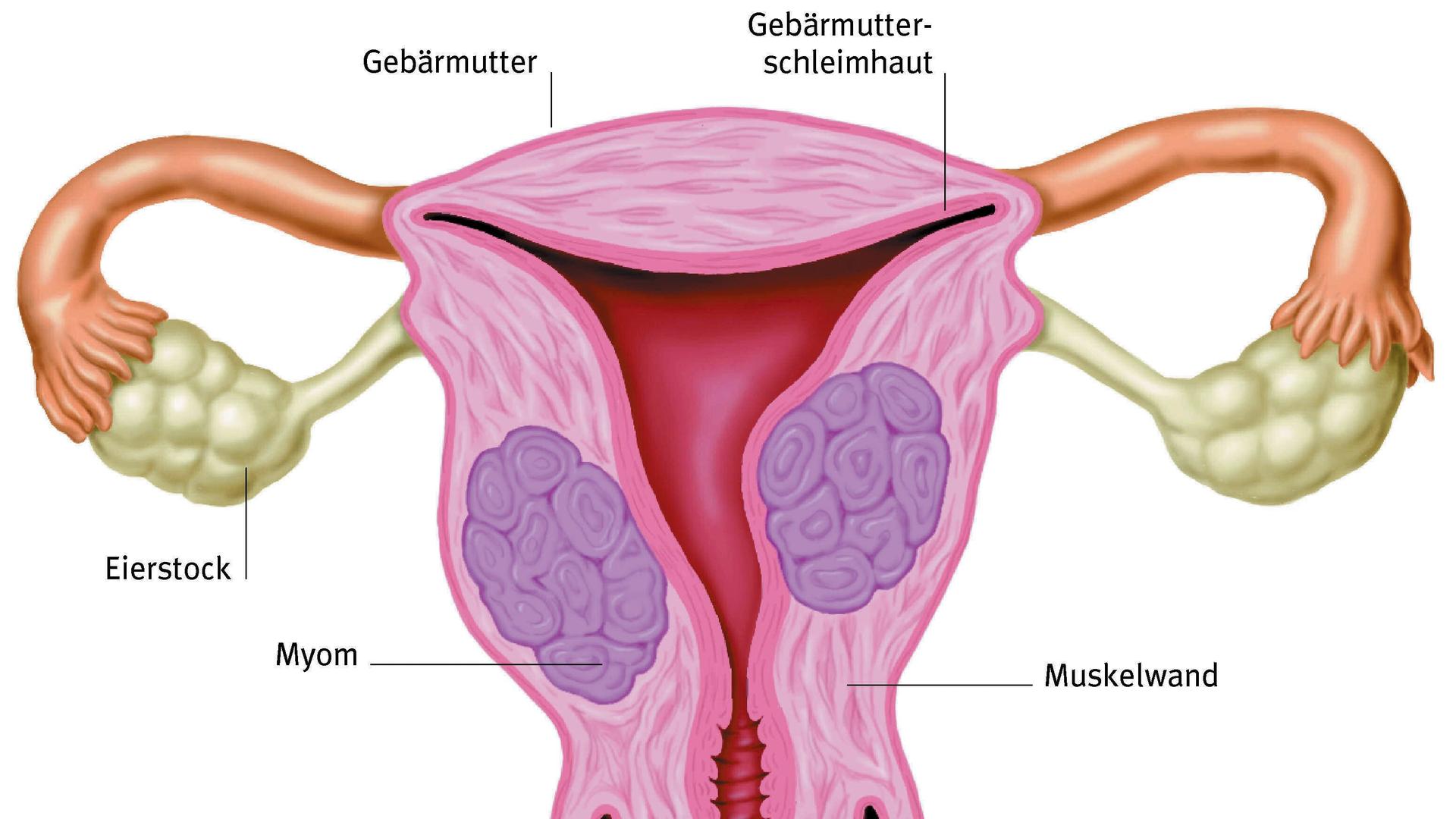
Die Sahlgrenska-Uniklinik in Göteborg. Die Frau auf dem Operationstisch ist Mitte 30 und hat keine Gebärmutter - eine angeborene Fehlbildung. Jetzt transplantieren ihr die Ärzte die Gebärmutter einer 61jährigen Spenderin.
"Wenn es irgendwo da draußen noch eine Chance auf ein eigenes Kind gibt, dann werden manche Leute alles dafür tun, um diese Chance zu ergreifen."
Anfang 2014, ein knappes Jahr nach der Transplantation, wird die Frau schwanger. Acht Monate später bringt sie einen gesunden Jungen auf die Welt.
"Mein Team und ich sind überglücklich. Und gleichzeitig war es irgendwie irreal. Wir können kaum glauben, dass wir es so schnell geschafft haben."
Ein paar Wochen früher, auf dem Jahreskongress der Europäischen Reproduktionsmediziner Anfang Juli in München. Mats Brännström hat gerade einen Vortrag gehalten, der große Saal im Kongresszentrum war brechend voll. Du bist jetzt eine Berühmtheit, hat ein Kollege danach zu ihm gesagt. Der Gynäkologe lächelt müde.
"Das war nur ein alter Freund, der mich im Fernsehen gesehen hat. Wir legen es nicht darauf an, in den Medien zu landen. Aber das Interesse ist groß. Weil es ethisch umstritten ist. Und weil es um ganz fundamentale Fragen geht."
Mats Brännström und sein Team an der Sahlgrenska-Universität haben insgesamt neun Frauen eine Gebärmutter transplantiert. Die Spenderorgane stammten von deren Müttern, Schwestern, Tanten, Freundinnen. Bei sieben Frauen scheint der Uterus normal zu funktionieren; sie haben regelmäßig ihre Menstruation. Jetzt versuchen sie, mittels künstlicher Befruchtung schwanger zu werden, erklärt er - dass eine der Frauen schon schwanger ist, sagt er nicht. Bis zur Geburt ist Nachrichtensperre.
"Schon vor der Transplantation haben wir den Frauen Eizellen entnommen und sie in der Petrischale mit den Spermien ihrer Partner befruchtet. Jetzt setzen wir einen Embryo nach dem anderen in die transplantierte Gebärmutter ein."
Die meisten Studienteilnehmerinnen waren schon ohne Uterus auf die Welt gekommen. Andere hatten ihn durch eine Krebserkrankung verloren. Für die Chance auf ein eigenes Kind nehmen die Frauen viel auf sich: die schwere Operation, die Einnahme von Immunsuppressiva, die künstliche Befruchtung. Es ist ein Experiment mit ungewissem Ausgang.
"Wir Ärzte, wir treffen immer wieder Frauen, die keine Kinder bekommen können, weil sie keinen funktionstüchtigen Uterus haben. Und ich denke, dass wir ihre Unfruchtbarkeit behandeln sollten - wie alle anderen Arten von Unfruchtbarkeit auch. Das wollen wir herausfinden. Und dann werden die Politik und die Versicherungen darüber entscheiden müssen, ob sie so eine Behandlung regulär anbieten - weil sie natürlich sehr teuer ist, und extrem schwierig."
Reproduktionsmedizin wagt Grenzgänge
Im Jahr 36 nach der Geburt des ersten Retortenbabies wagt die Reproduktionsmedizin Grenzgänge, die weit über die künstliche Befruchtung hinausgehen. Frauen ohne Gebärmutter bekommen eine transplantiert. Frauen, die mit dem Kinderkriegen einfach noch warten wollen, lassen ihre Eizellen einfrieren und Jahre später wieder auftauen. Und wer keine Eizellen oder Spermien hat, kann sie sich vielleicht bald schon im Labor heranziehen lassen - aus den eigenen Stammzellen. Um den Wunsch nach einem eigenen Kind zu erfüllen, werden die Grenzen der Biologie verschoben. Fast alle dieser Verfahren befinden sich im experimentellen Stadium. Ihr Nutzen, ihre Risiken - unbekannt.
Die Fertilitätsklinik am Rigshospitalet in Kopenhagen. Ein Krankenhausflur. Weiße Wände, meterlang; die Sessel aus hellem Holz und grobem Stoff. Ein paar Frauen, die Infusionen in ihre Venen sickern lassen, lesen, schweigen. Auf Flachbildschirmen Großaufnahmen von Pipetten und Petrischalen. Weiße Kittel, blaue Handschuhe. Wer hierherkommt, hat die Grenzen der Fruchtbarkeit am eigenen Leib erfahren. Ein Mann um die 30 starrt mit verschränkten Armen vor sich hin. Eine Frau weint.
"Unfruchtbarkeit ist ein Riesenproblem in Dänemark. Jedes zehnte Kind wird hierzulande nach einer Fruchtbarkeitsbehandlung geboren - das sind Tausende."
Die Reproduktionsmedizinerin Kathrine Birch Petersen sitzt in einem Behandlungszimmer weiter hinten im Gang. Ein Ultraschallgerät, ein gynäkologischer Stuhl. Die Jalousien vor den Fenstern sind zugezogen.
"Neue Techniken in der Reproduktionsmedizin voranzutreiben ist eine gute Sache. Aber die meisten Paare werden davon nicht profitieren. In erster Linie haben wir weniger Kinder, weil wir einfach zu lange warten. Und deshalb versuchen wir hier einen anderen Weg."
Kathrine Birch Petersen und ihre Kollegen betreiben hier, am Kopenhagener Rigshospitalet, die Fertility Assessment and Counselling Clinic. Eine Fruchtbarkeits-Beratungsstelle.
Die Zeit zum Kinderkriegen wird vom Körper vorgegeben, und sie ist auf wenige Jahre beschränkt. Die Ärzte am Rigshospitalet wollen, dass junge Menschen sich dessen bewusst sind, sich danach richten. Wer wissen möchte, wie es um die eigene Zeugungs- oder Gebärfähigkeit bestellt ist, kann sich hier also untersuchen lassen. Abschätzen, wie viel Zeit noch für eine natürliche Schwangerschaft bleibt. Die meisten Klienten sind Mitte 30, weiblich, kinderlos - wie Elisabeth.
"Ich bin 33 - nein, sorry, 34 Jahre alt und bin Journalistin. Seit einem Jahr bin ich verheiratet. Mein Mann hat schon einen Sohn, der jede zweite Woche bei uns ist - Hugo. Und ja, irgendwie ist er auch mein Kind. Mein Mann sagt immer, dass er sich eine Tochter wünscht, die so aussieht wie ich früher. Ich war nämlich wirklich ein süßes Kind! - Jedenfalls: er sagt, dass wir es einfach versuchen sollten. Ich bin diejenige, die da eher zögerlich ist."
Die Fertility Assessment and Counselling Clinic ist auch ein Forschungsprojekt. Die Ärzte wollen die entscheidenden Risikofaktoren für eine Unfruchtbarkeit ermitteln. Über allem schwebt ein Gedanke, der nach Ansicht der Kopenhagener in der Reproduktionsmedizin bislang vernachlässigt wird: Prävention. Eine drohende Unfruchtbarkeit erkennen, bevor sich die Frauen und Männer in einer Fertilitätsklinik wiederfinden.
"Ich glaube viel an Schicksal, und dass alles zu einem kommt, wenn es kommen soll. Irgendwie hatte ich schon immer das Gefühl, dass es für mich schwierig werden könnte. Ich war noch nie schwanger. Und mit 34 waren viele schon mal schwanger, auch unbeabsichtigt. Ich nicht. Und deshalb dachte ich oft: vielleicht kann ich gar nicht."
Beratungsstelle schätzt Chancen auf Schwangerschaft ab
Kathrine Birch Petersen wird Elisabeths ovarielle Reserve vermessen, die Fähigkeit ihrer Eierstöcke, fruchtbare Eizellen zu produzieren. Die ovarielle Reserve gibt Hinweise darauf, wie gut Elisabeths Chancen auf ein eigenes Kind stehen - jetzt und in den kommenden Jahren.
"Wir besprechen zuerst den Fragebogen, den sie zu Hause ausgefüllt hat. Ich möchte noch mehr Details. Hat sie regelmäßig ihre Periode, hat sie einen stressigen Job - und frage sie nach ihrer Mutter."
Rauchen, Stress, Clamydien-Infektionen, Blinddarm-Operationen. All das kann die Fruchtbarkeit einschränken. Die Fortpflanzungsfähigkeit ist auch genetisch begrenzt - deshalb will die Ärztin wissen, wann die Mütter ihrer Klientinnen in die Menopause gekommen sind. Elisabeths Mutter war früh dran: mit Mitte 40. Schon zehn Jahre vor der Menopause, sagt Kathrine Birch, ist es fast unmöglich, noch ein Kind zu bekommen.
"Wir machen jetzt noch einen Bluttest, der die Konzentration des Anti-Müller-Hormons misst. Dieses Hormon wird von kleinen Zellen ausgeschüttet, die um die Eizellen herum liegen. Der Bluttest gibt uns Informationen darüber, wie viele Eizellen heranreifen."
Zum Schluss wird sich die Ärztin Elisabeths Eierstöcke direkt ansehen, mit Hilfe eines transvaginalen Ultraschalls. Die Fertility Assessment and Counselling Clinic gibt es seit rund zwei Jahren. Sie ist die weltweit erste ihrer Art. Inzwischen gibt es ähnliche Projekte in Schweden und in England. In Kopenhagen ist die Nachfrage groß.
"Wir haben bislang mehr als 1000 Klienten untersucht, und allein gestern haben uns 50 angerufen",
sagt Anders Nyboe Andersen, der das Projekt am Rigshospitalet ins Leben gerufen hat.
"Viele müssen sich nicht beeilen. Aber bei manchen Frauen hat die ovarielle Reserve schon mit 35 massiv abgenommen. Natürlich können sie immer noch schwanger werden, aber sie haben nicht mehr viel Zeit, und das müssen sie wissen. Wenn sie einen Partner haben, sollten sie vielleicht ein bisschen Druck auf ihn ausüben. Und für Single-Frauen gibt es in Dänemark die Möglichkeit, auf Samenspenden zurück-zugreifen. Eine von 100 Schwangerschaften entsteht auf diese Weise - eine enorme Zahl."
Alle, die die Beratungsstelle aufgesucht haben, werden noch zwei Jahre nachverfolgt. Die ersten 140 Fälle sind bereits abgeschlossen.
Kathrine Birch : "Und von den 140 Frauen sind 89 in dem Zeitraum schwanger geworden. 59 Babies wurden geboren - sehr viel mehr als normal!"
Eizellen. Sie sind der Schlüssel zur Fruchtbarkeit. Und sie sind ihr wundester Punkt. Im Gegensatz zu den Spermien, die permanent neu gebildet werden, werden die Eizellen der Frau höchstwahrscheinlich nur einmal im Leben - noch im Mutterleib - angelegt und aufgebraucht.
"Sie haben nach den Eierstöcken gefragt. Hier habe ich zwei Beispiele."
Kathrine Birch zieht zwei Ultraschallbilder aus der Folie.
"Das hier ist ein normaler Eierstock. Er hat die Form einer Bohne, mit lauter jungen Eizellen. Hier, die schwarzen Punkte: eins zwei drei vier fünf sechs sieben acht neun zehn, also hier gibt es zehn so genannte Ovarialfollikel, das ist normal, das ist ein normaler, rechter Eierstock. Aber wenn wir uns den Eierstock einer anderen Patientin ansehen...hier, er ist kleiner, und es gibt viel weniger Eizellen. Wir können nur eins, zwei...zwei Eier zählen."
Eingefrorene Eizellenreserve
Was weg ist, ist weg. Doch was tun, wenn die Jahre vergehen und kein passender Mann in Sicht ist? Die moderne Reproduktionsmedizin bietet neuerdings auch dafür eine Lösung. Man lasse sich in möglichst jungen Jahren Eizellen entnehmen und einfrieren. Jahre später - wenn die natürliche Eizellenreserve längst aufgebraucht ist - können sie aufgetaut, künstlich befruchtet und mittels assistierter Reproduktionstechniken in den Unterleib gesetzt werden. Social Freezing heißt das Verfahren, das von Enthusiasten als endgültiger Befreiungsschlag der Frau gefeiert wird. In den USA und im europäischen Ausland wird das Social Freezing schon seit einigen Jahren angeboten. Auch in Deutschland haben schon ein paar hundert Frauen ihre Eizellen einfrieren lassen - für ein paar tausend Euro.
"Social Freezing ist keine Versicherung. Es ist eher ein Lottoschein. Man hat die Chance, vielleicht noch ein Kind zu bekommen. Aber es gibt keine Sicherheit",
sagt dagegen Heidi Mertes vom Bioethik-Institut im belgischen Gent. In der Tat gibt es bislang kaum Zahlen, die den Erfolg der Methode belegen. Heidi Mertes hat sich die Praxis des Social Freezing weltweit angesehen. Wunsch und Wirklichkeit klaffen oft weit auseinander.
"Im Idealfall würde eine Frau mit 28 oder 30 ihre Eizellen einfrieren. Vielleicht, weil sie gerade eine Beziehung beendet hat und weiß, dass es dauern wird, bis sie jemand Neues gefunden hat. Dann könnte Social Freezing eine gute Sache sein."
Die Realität sieht oft anders aus. Die Frauen sind im Schnitt 38 Jahre alt, die Folgen bekannt: Je älter eine Frau, desto weniger funktionstüchtige Eizellen können entnommen werden. Das Risiko einer Chromosomenstörung steigt. Und die Erfolgsaussichten einer künstlichen Befruchtung sinken.
Mertes: "So, wie es im Moment läuft, denke ich, dass viele Frauen getäuscht werden. Manche Kliniken frieren sogar noch Eizellen von Frauen ein, die über 40 sind. Und die Frauen denken dann, dass sie immer noch gute Chancen auf eine Schwangerschaft haben. Aber in Wahrheit sind sie zu spät dran. Sie hätten ihre Eizellen viel früher einfrieren müssen."
Kathrine Birch: "One, two, three, four, five, six, seven, eight, nine, ten ."
Auch das Social Freezing hat seine Grenzen. Man braucht dafür funktionstüchtige Eizellen. Wenn die ovarielle Reserve schwindet, hilft auch kein Einfrieren mehr.
"We count only one, two - two eggs on these ovary."
Stammzellen als Ausweg umstritten
Was weg ist, ist weg. Oder doch nicht?
"Jonathan Tilly war schon vor Jahren der Ansicht, dass Eierstöcke Stammzellen enthalten. Stammzellen, die ein Leben lang neue Eizellen hervorbringen könnten."
Evelyn Telfer, Professorin für Reproduktionsbiologie an der Universität Edinburgh.
"Also, Tillys Vorstellungen liefen völlig gegen den Strich. Seit den fünfziger Jahren war die Wissenschaftsgemeinde davon überzeugt, dass Eizellen kontinuierlich verloren gehen. Dass sie sich im Laufe des Lebens nicht regenerieren können."
Auch Evelyn Telfer war anfangs skeptisch. Dann hat sie Jonathan Tilly in seinem Labor besucht, damals noch am Massachusetts General Hospital in Boston, und sich die Zellen angesehen, die er im Eierstock gefunden hatte. Das war 2012. Inzwischen hat sie die Zellen selbst aus menschlichem Eierstockgewebe isoliert. Und in der Petrischale, sagt sie, hätten sie sich zu sehr frühen Eizellen entwickelt.
"Diese Zellen können isoliert werden, aus den Eierstöcken von Frauen, von Mäusen, von Affen. Wir wissen nur sehr wenig über sie. Aber sie scheinen sämtliche Eigenschaften zu erfüllen, die man bei einer ovariellen Stammzelle erwarten würde."
Bis heute tobt ein regelrechter Glaubenskrieg darüber, ob die Stammzellen im Eierstock wirklich existieren. Einige Forscher haben sie - trotz intensiver Suche - nämlich nicht aufspüren können. Andere ärgern sich über die vollmundigen Versprechungen, die Jonathan Tilly formuliert: Etwa, dass man mit Hilfe der Stammzellen die Menopause anhalten könne. Interviews mag Jonathan Tilly heute nicht mehr geben. Und auch Evelyn Telfer gerät immer wieder zwischen die Fronten.
"Viele meiner Kollegen haben zu mir gesagt, dass ich auf die dunkle Seite wechsle. Sie sagen: Wir glauben nicht an diese Zellen. Ich erwarte von niemandem, an irgendwas zu glauben. Ich erwarte, dass wir uns wie Wissenschaftler verhalten und mehr über diese Zellen herausfinden, bevor wir sie abtun. Im Moment wissen wir einfach noch nicht genug, um zu sagen: Sie sind die Rettung oder sie sind unnütz."
Im Moment weiß niemand, ob die Stammzellen auch unter den ganz normalen physiologischen Bedingungen, wie sie im Eierstock herrschen, funktionieren. Ob und unter welchen Voraussetzungen sie tatsächlich neue Eizellen hervorbringen könnten. Doch selbst wenn die Stammzellen im Eierstock vollkommen stillgelegt wären: Sie hätten großes Potential, glaubt Evelyn Telfer.
"Wenn es diese Zellen gibt, wenn wir sie aus dem Eierstock isolieren und außerhalb des Körpers zu Eizellen heranziehen könnten - zu gesunden Eizellen, die sich befruchten lassen - dann könnten wir damit Frauen helfen, die sonst unfruchtbar sind."
Eizellen, passgenau hergestellt aus den Stammzellen einer Frau. Stammzellen lassen sich, wenn einmal gewonnen, unendlich vermehren. Die ovarielle Reserve aus dem Labor - sie wäre unerschöpflich. Man bräuchte dafür nicht unbedingt Stammzellen aus dem Eierstock. Vielleicht tut es auch jede andere Stammzelle. Das ist schließlich der Clou an Stammzellen: dass sie sich in alle möglichen Gewebe verwandeln können.
Hautzellen zu Stammzellen umprogrammiert
"Eigene Kinder sind eine große Sache. Die Leute stehen unter einem enormen Druck."
Susana Chuva de Sousa Lopes, Stammzellforscherin.
"Der Druck ist groß, und die Frauen werden immer älter. Und die meisten wollen nun mal eigene Kinder haben, keine adoptierten. Wenn man die Möglichkeit hätte, Spermien und Eizellen im Labor heranzuziehen - das würde einem schon viel Flexibilität geben."
An der Uniklinik in Leiden forscht Susana Chuva unter anderem mit so genannten IPS-Zellen - zu Stammzellen umprogrammierten Hautzellen. Die will sie im Labor zu Eizellen heranziehen.
"Der Status Quo von künstlichen Ei- und Samenzellen: Wir können sie definitiv noch nicht komplett im Labor herstellen. Aber wir sind auf dem Weg dahin."
Die natürliche Entwicklung von Keimzellen komplett in der Petrischale nachahmen - davon sind die Forscher noch weit entfernt. Der Prozess ist äußerst komplex: Im Hoden oder im Eierstock wird er von den Zellen in der unmittelbaren Umgebung gesteuert, der so genannten Nische. Sie leitet die Meiose ein, also die für jede Keimzelle essentielle Teilung des Erbguts; sie weist den Weg bis hin zum funktionstüchtigen Spermium, zur funktionierenden Eizelle. Forscher haben das Zusammenspiel längst noch nicht vollständig verstanden. Im Labor, sagt Susana Chuva, seien sie schon froh, wenn sie mit den Stammzellen in der Petrischale die frühesten Entwicklungsschritte einer Eizelle hinkriegen.
"Das Interesse ist groß, und viele Leute forschen auf dem Gebiet. Aber wir müssen einen kleinen Schritt nach dem anderen gehen."
2012 ist einem Forscherteam aus Japan der bislang wohl größte Erfolg gelungen. Sie wandelten Hautzellen von Mäusen in der Petrischale zu ganz frühen Keimzellen, so genannten Urkeimzellen, und pflanzten diese dann zurück in Versuchsmäuse. Im Mäusehoden entwickelten sich die Urkeimzellen weiter zu Spermien - und im Eierstock zu Eizellen. Beide waren funktionsfähig, mit beiden konnten die Japaner Mäusenachwuchs züchten. Seitdem bekommen sie Dutzende Emails von verzweifelten Paaren, die sich als Versuchspersonen zur Verfügung stellen wollen. Doch genau hier stößt die Forschung an ihre Grenzen.
Chuva de Sousa Lopes: "Theoretisch könnten wir das, was die Japaner bei Mäusen gemacht haben, ja auch beim Menschen versuchen. Wir verwandeln iPS-Zellen in frühe Keimzellen und transplantieren sie dann in den Hoden von Männern. Aber wahrscheinlich würden wir nie die Erlaubnis für solche Experimente bekommen."
Möglichkeit für gleichgeschlechtliche Paare
Die Ergebnisse aus Japan verleiten aber noch zu ganz anderen Gedankenspielen. Wenn man aus Hautzellen frühe Keimzellen machen kann, die sich - je nach Umgebung - entweder zu Spermien oder zu Eizellen entwickeln, dann wäre es möglich, aus der Hautzelle eines Mannes eine Eizelle herzustellen - mit einem männlichen Chromosomensatz. Und aus der Hautzelle einer Frau Spermien - mit einem weiblichen Chromosomensatz. Die Grenze zwischen männlich und weiblich verschwimmt. Homosexuelle Paare könnten ihre eigenen Kinder zeugen. Und theoretisch könnte sich ein Mensch sogar ohne Partner fortpflanzen.
"Ähm - that's a tough question. I don't know",
sagt Susana Chuva,
"wenn zwei Frauen ein gemeinsames Kind haben möchten - ja, warum nicht? Am Ende geht es doch nur darum, einen Weg zu finden, zwei Chromosomensätze zu vereinen. Wenn das Verfahren sicher wäre - da wäre ich persönlich liberal eingestellt. Vielleicht ein bisschen zu liberal."
"Ich persönlich sehe keinen Sinn darin",
meint dagegen Evelyn Telfer,
"natürlich würde mich die Biologie dahinter interessieren. Aber vom praktischen Standpunkt her finde ich, dass wir solchen Anwendungen einen Riegel vorschieben sollten."
Die Entwicklung künstlich erzeugter Keimzellen wird auch vom deutschen Ethikrat kritisch beäugt. Die Mitglieder fordern einen gesellschaftlichen Diskurs über mögliche Folgen - und äußern Bedenken bezüglich der medizinischen Sicherheit solcher Verfahren. Wie weit sind wir bereit zu gehen, für ein genetisch eigenes Kind? Und wie weit dürfen wir gehen? Für viele Bioethiker steht dabei das Wohlbefinden des zukünftigen Kindes im Vordergrund.
Heide Mertes: "Wir wissen noch nicht, wie sich einige Anwendungen auswirken. Manche Paare sind aber so sehr auf ein eigenes Kind fokussiert, dass sie bereit sind, große Risiken einzugehen - auch für ihr zukünftiges Kind."
Beispiel künstliche Keimzellen: Die Mäuse, die nach den Experimenten in Japan geboren worden sind - mit Hilfe von Eizellen, die zumindest zum Teil im Labor kreiert wurden - diese Mäuse schienen auf den ersten Blick gesund zu sein. Allerdings hatten sie ihrerseits Schwierigkeiten, gesunde Eizellen zu bilden. Und vor Jahren schon hatte eine andere Forschergruppe Mäuse mit Hilfe von künstlichen Spermien gezeugt - alle Mäusebabys starben kurz nach der Geburt.
Mertes: "Für mich stehen die Ärzte und Wissenschaftler in der Verantwortung. Wenn eine neue Technologie große Risiken birgt, dann sollten wir vielleicht sagen, OK, dann sollten wir es nicht ausprobieren. Auch wenn sich manche Paare darauf einlassen würden."
Umstrittene Praktiken
Auch die Uterustransplantation in Göteborg ist umstritten.
Mats Brännström: "Wie bei allen neuen Ansätzen gibt es Gegner und Befürworter. Wir haben die Transplantation wissenschaftlich sehr sorgfältig vorbereitet und den Eingriff jahrelang an Versuchstieren trainiert."
Trotz allem: der Eingriff ist schwierig. Das gibt auch Mats Brännström zu. Entnahme und Transplantation haben bis zu 13 Stunden gedauert. Die Frauen lagen anschließend eine Woche im Krankenhaus. Bei zweien musste die Gebärmutter wieder entfernt werden, weil es Komplikationen gab; die anderen müssen Immunsuppressiva einnehmen, damit das fremde Organ nicht abgestoßen wird. Dazu kommt das fortgeschrittene Alter der gespendeten Gebärmütter.
"Ein älterer Uterus ist nicht unbedingt für eine Schwangerschaft gedacht. Aber wir wissen von künstlichen Befruchtungen, dass sich befruchtete Eizellen immer noch einnisten können, dass Schwangerschaften entstehen können."
Das Kind, das jetzt geboren wurde, wuchs in einem Spender-Uterus mit dem stolzen Alter von 61 Jahren heran. Der Junge hat sich völlig normal entwickelt. Die Schwangerschaft verlief allerdings nicht ganz reibungslos: Die Mutter hatte mehrere leichte Abstoßungsreaktionen, die die Ärzte aber in den Griff bekamen. In der 32. Woche erlitt sie dann eine Präeklampsie - eine so genannte Schwangerschaftsvergiftung, die möglicherweise durch die Immunsuppressiva ausgelöst wurde. Das Kind musste per Kaiserschnitt geholt werden, ein paar Wochen zu früh.
Brännström: "Eine Schwangerschaft nach einer Uterustransplantation ist immer eine Hochrisikoschwangerschaft. Und genauso sollte sie auch behandelt werden."
Wie weit gehst du für ein eigenes Kind? Es wäre spannend, darüber mit Mats Brännströms Probandinnen selbst zu sprechen. Aber sie geben vorerst keine Interviews. Das war eine der Bedingungen, um an der Studie teilzunehmen.
"Natürlich sehen manche in Schweden die Uterustransplantation kritisch. Aber das sind nie Frauen. Es sind immer Männer. Ältere Männer. Und wahrscheinlich sind sie deshalb so kritisch, weil sie noch nie mit den betroffenen Frauen zu tun hatten. Weil sie Unfruchtbarkeit noch nie als großes Problem wahrgenommen haben.
"Manche Ärzte und Forscher - nicht alle. Aber selbst, wenn es Risiken für das Kind gibt, argumentieren manche: das sei nun mal die einzige Option, die diese Frauen haben."
Heidi Mertes, Bioethikerin.
"Das ist ihre einzige Option, sagen sie, und deshalb müssen wir die Risiken akzeptieren. Und dem kann ich nicht zustimmen. Denn es gibt immer noch eine andere Option. Und die ist, keine Kinder zu haben."
Grenzenlose Möglichkeiten?
Die Möglichkeiten der Reproduktionsmedizin scheinen grenzenlos. Noch weiß niemand, ob sie die Versprechen, die sie geben, werden halten können. Und wie immer wird jede Gesellschaft für sich selbst entscheiden müssen, wie weit sie mitgehen will. Leicht wird das nicht. Denn letztlich liegen die Grenzen für jeden woanders.
Elisabeth, die Journalistin aus Kopenhagen, hat die Untersuchung überstanden. Ihre Eierstöcke sehen gut aus. Aber die Ärzte haben eine Endometriose bei ihr festgestellt, eine Erkrankung der Gebärmutterschleimhaut, die eine Schwangerschaft erschweren kann. Wenn sie ein Kind haben will, sollte sie jetzt damit anfangen. Eine künstliche Befruchtung käme für Elisabeth nicht in Frage. Sie kann sich auch ein Leben ohne eigene Kinder vorstellen. Sie weiß, dass sie eine Ausnahme ist.
"Als ich vorhin hier angekommen bin, saß diese Frau im Gang, die sich fest an ihren Mann geklammert hat. Ich habe sie nur eine Sekunde gesehen - aber diese Verzweiflung in ihrem Gesicht, so traurig. Und ich hoffe, dass sie für solche Frauen gute Nachrichten haben."