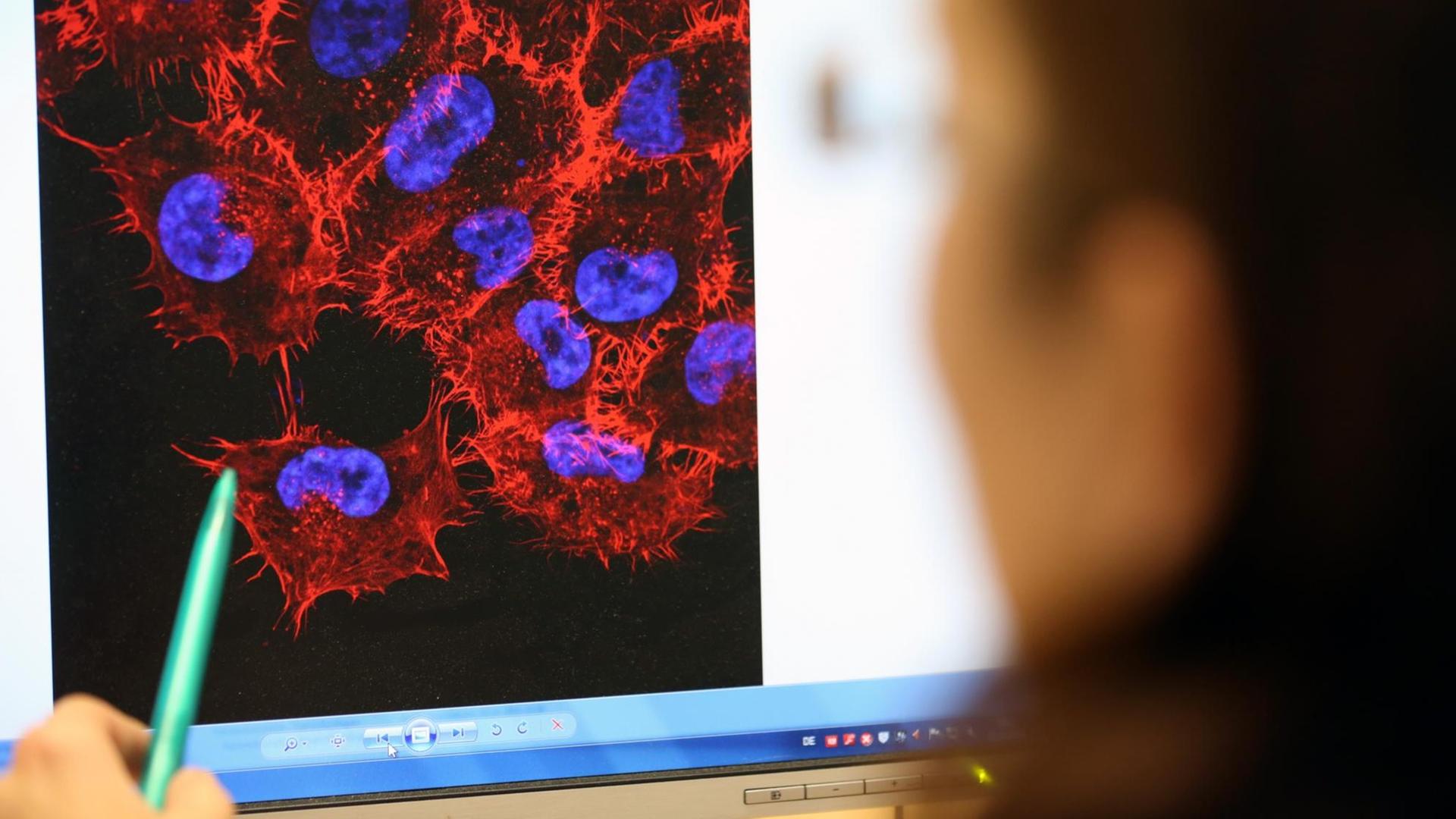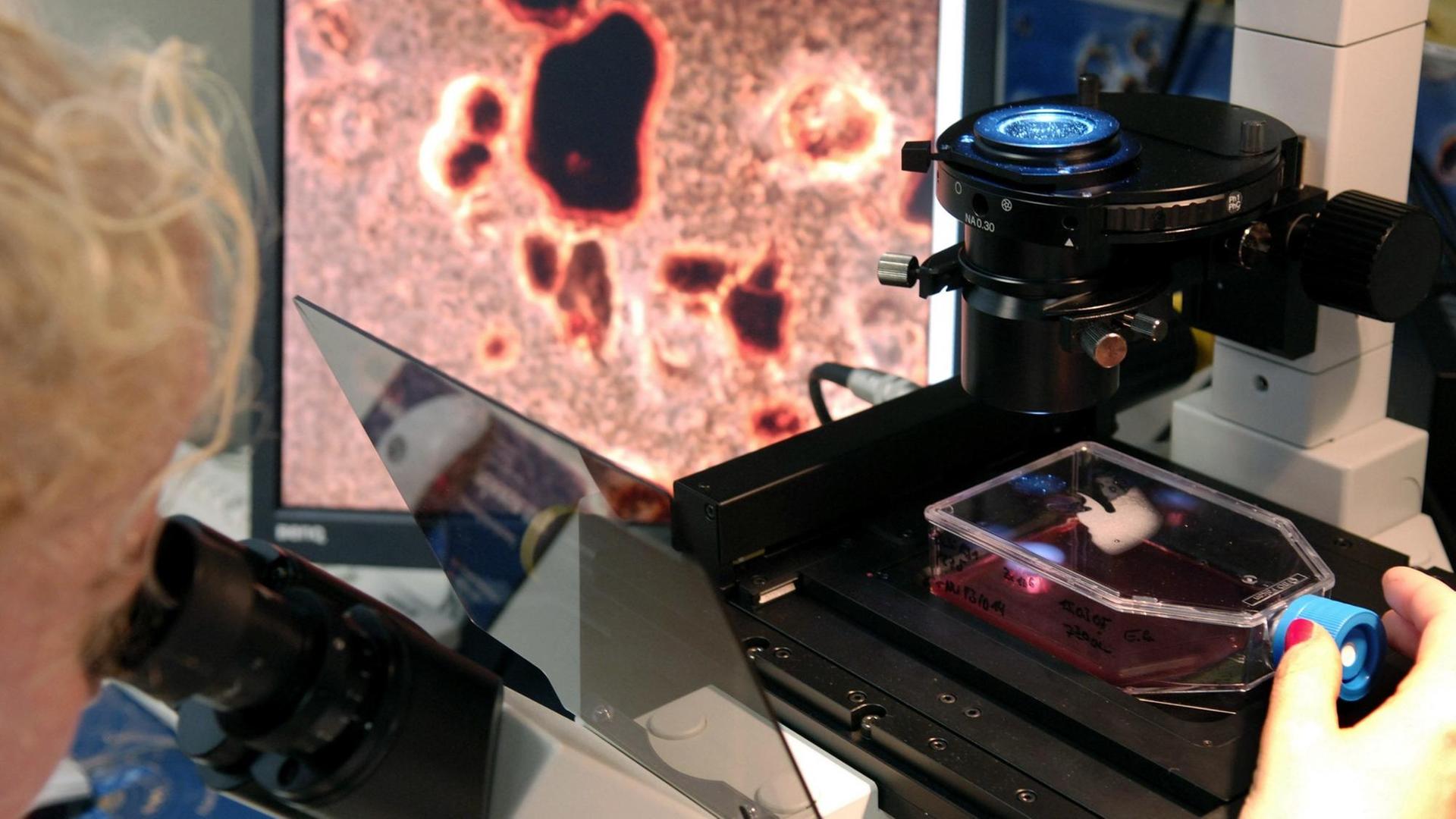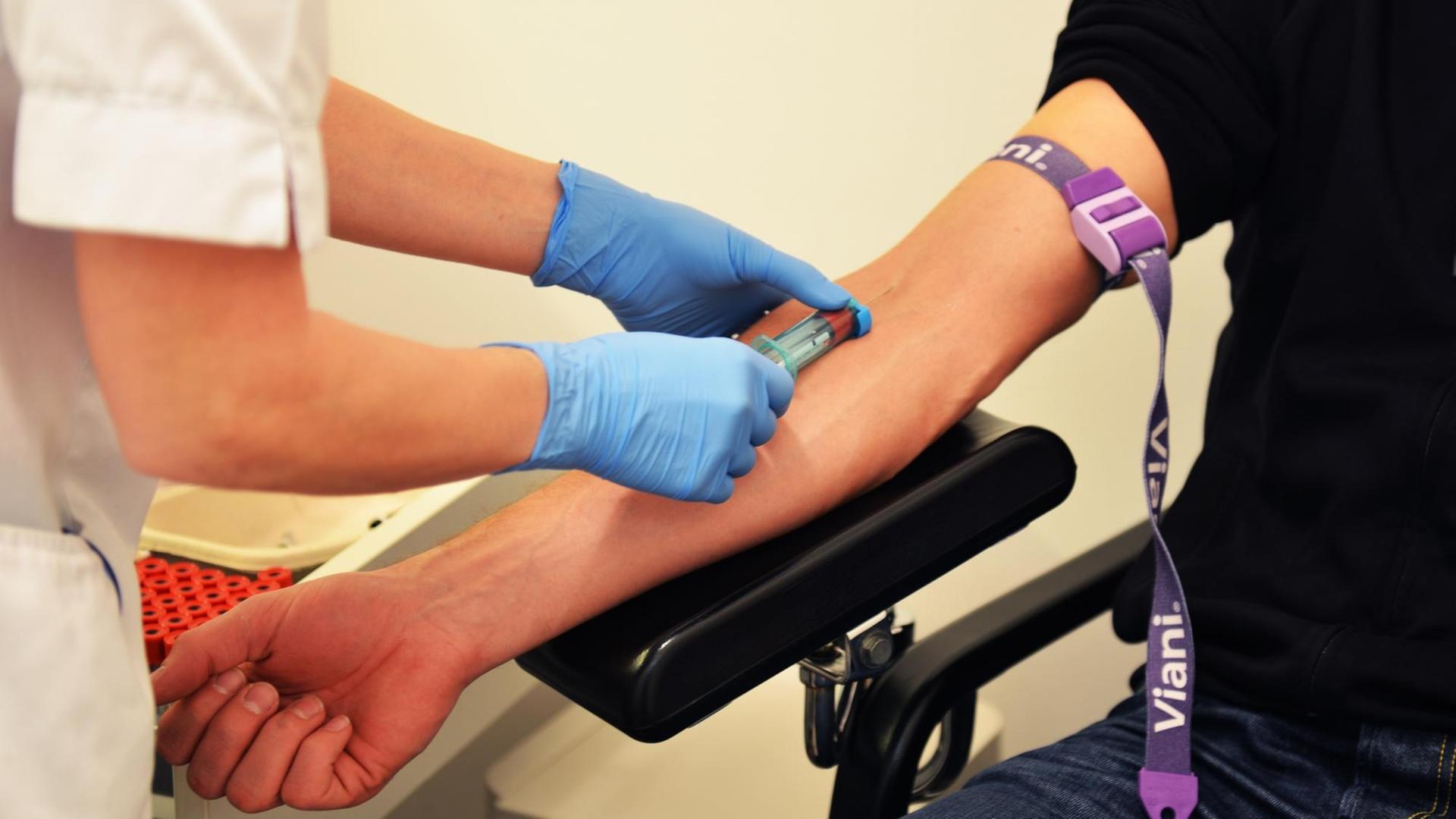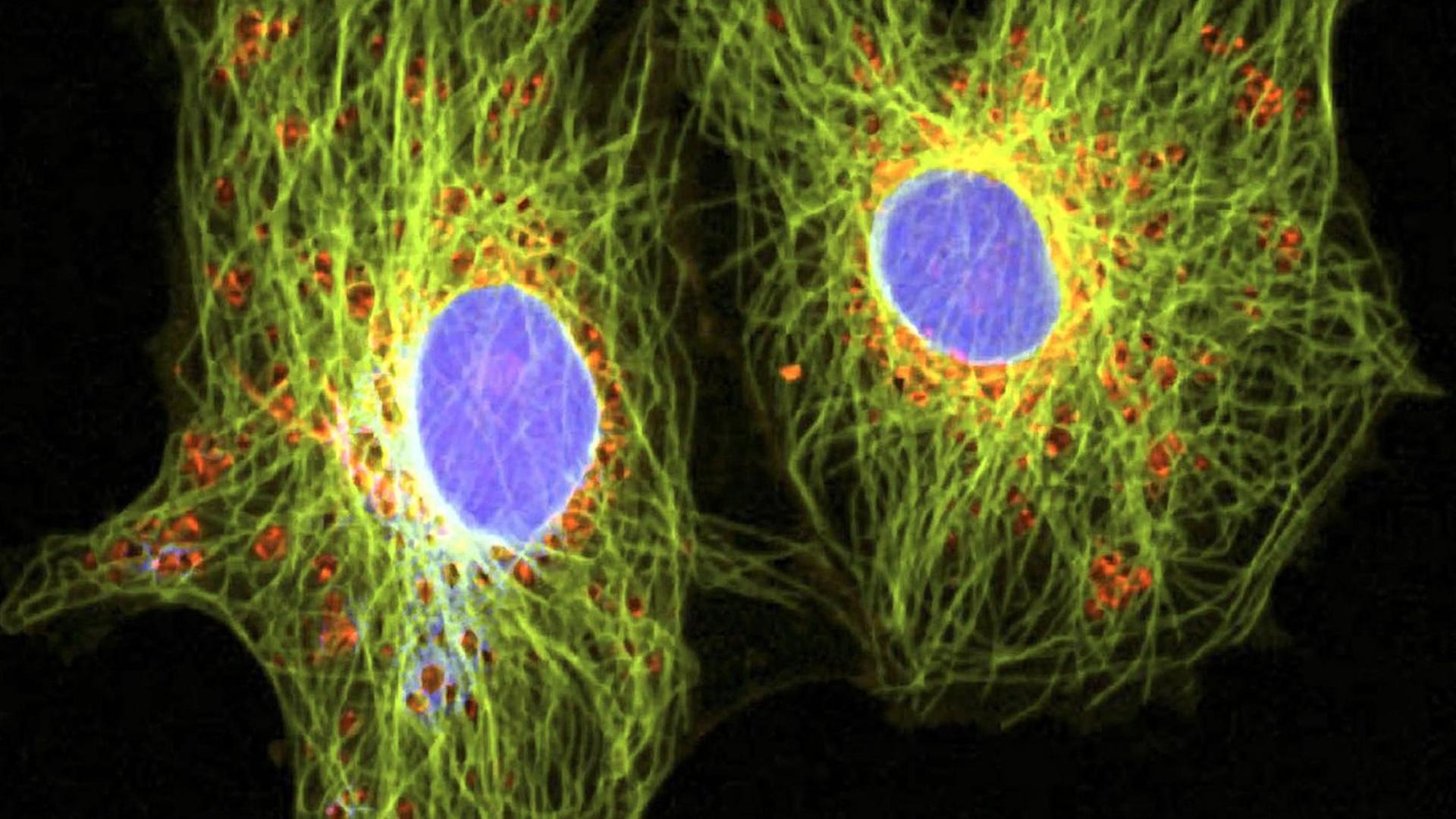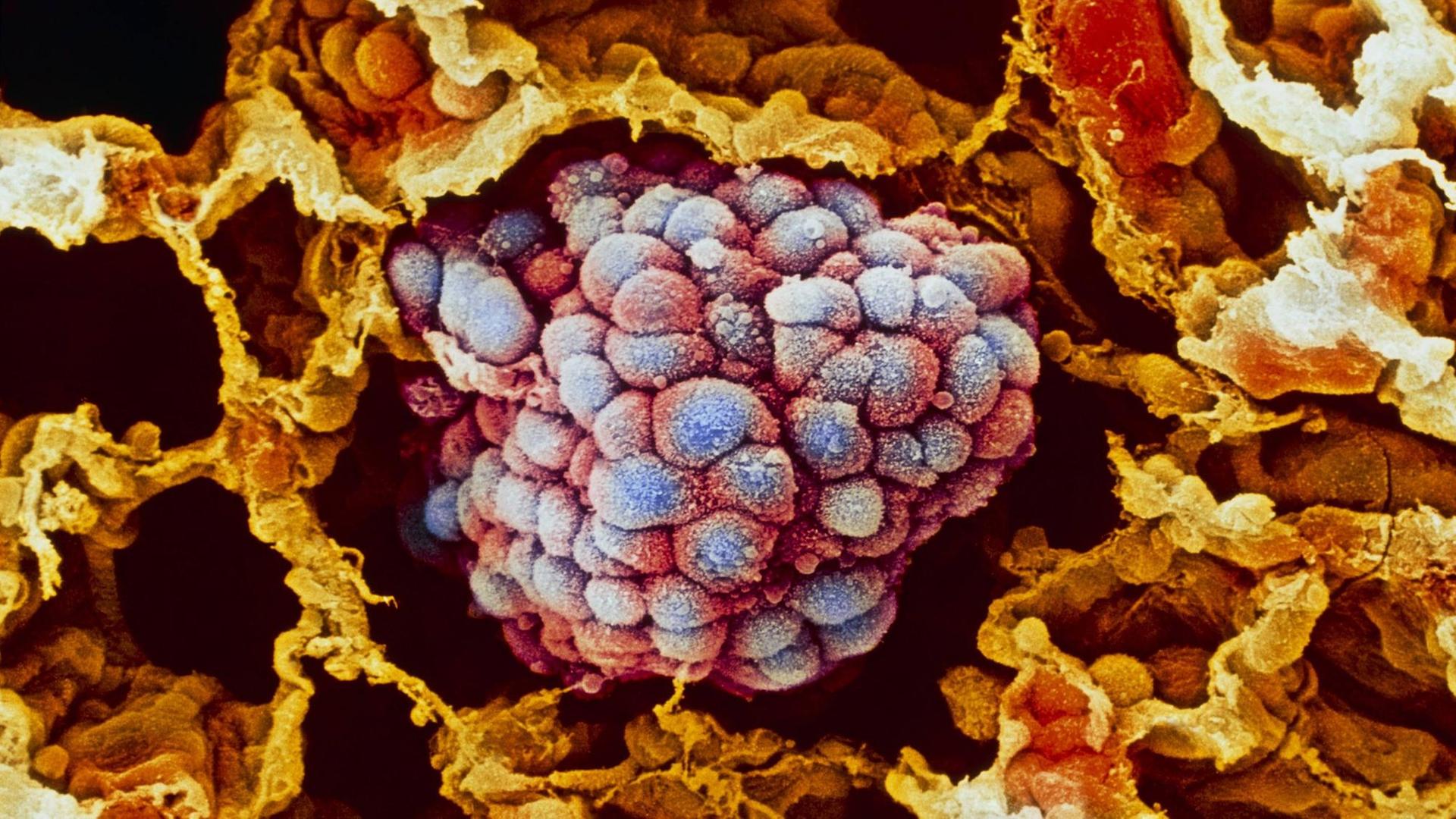
Uli Blumenthal: Krebs ist nicht gleich Krebs. Bei Lungen- oder Brustkrebs zum Beispiel kennt die Tumormedizin jeweils rund 30 Varianten oder Untergruppen, und je nach Art oder Lage des Tumors kommen Operationen, Chemo-, Strahlen-, Hormon- oder Immuntherapien infrage. Ein Mittel, das bei einem Patienten beispielsweise die Metastasen schrumpfen lässt, das löst bei einem anderen Patienten unangenehme Nebenwirkungen aus. Im Labor gezüchtete Mini-Tumoren, sogenannte Tumor-Organoide aus Patientengewebe, sollen künftig dabei helfen vorherzusagen, wie gut ein Krebsmedikament beim jeweiligen Patienten wirkt. Das Fachjournal "Science" veröffentlicht heute eine Studie, die solche Mini-Tumore bei Patienten mit Krebserkrankungen des Magen-Darm-Traktes untersucht hat.
Ich bin jetzt telefonisch verbunden mit Professor Dr. Michael Boutros, Leiter der Abteilung für Signalwege und funktionelle Genomik am Deutschen Krebsforschungszentrum in Heidelberg. Herr Professor Boutros, die Etablierung von solchen dreidimensionalen Mini-Organen aus verschiedenen Tumoren ist an sich ja nicht neu, die Autoren dieser Studie jetzt in "Science" sprechen von einer bahnbrechenden Arbeit. Wo sehen Sie die Stärke der Publikation und der Studie, die heute veröffentlicht wird?
Michael Boutros: Das ist jetzt ein sehr aktiv beforschtes Gebiet, wie man aus Tumoren diese Mini-Tumore in einer Zellkultur oder im Labor generieren kann, und diese Studie ist sicherlich ein wichtiger Schritt und geht den wichtigen Schritt, sozusagen zu vergleichen, wie diese Mini-Tumore ansprechen, auch im Vergleich dazu, wie die Patienten dazu angesprochen haben. Das ist sicherlich nur ein erster Schritt, den die Autoren dieser Studie gegangen sind, aber die Studie zeigt, dass bei vielen der Patienten ein sehr ähnliches Ansprechen auf Medikamente beobachtet wird wie auch bei den im Labor gezüchteten Mini-Tumoren. Und das ist schon ein wichtiger Schritt, der durch weitere Studien sicherlich noch verstärkt und bestätigt werden muss, der aber diese Mini-Organoide oder Mini-Organe letztendlich als Methode etabliert, um gerade das Ansprechen auf Medikamente vorhersagen zu können. Es gibt viele andere Methoden, das auch zu tun – über die Bestimmung sozusagen von Genmutationen zum Beispiel oder histopathologische Untersuchungen. Letztendlich wird es wahrscheinlich ein Zusammenführen von unterschiedlichen Informationen sein, die eine bessere Vorhersage ermöglichen, wie Tumore sich entwickeln und mit welchen Medikamenten sie am besten behandeln kann.
Sehr hohe Zahlen, mit denen man vorsichtig umgehen sollte
Blumenthal: Die Autoren der Studie, die heute im Fachjournal "Science" veröffentlicht wird, sprechen davon, dass ihre Organoide zu 88 Prozent darin erfolgreich waren, zu prognostizieren, ob ein Patient gut auf eine gegebene Therapie anspricht, und gar zu 100 Prozent erfolgreich prognostizieren konnten, ob ein Patient auf die gegebene Therapie nicht anspricht. Das sind ja schon überraschend gute oder fast sehr gute Zahlen.
Boutros: Das sind sehr hohe Zahlen, aber ich glaube, auch da muss man etwas vorsichtig sein, weil die Studie nicht besonders groß ist. Also letztendlich bezieht sich das vielleicht auf 20 oder 30 Testverfahren, die sie durchgeführt haben. Da wird es sicherlich noch größere klinische Studien brauchen, um das wirklich substanziell belegen zu können. Was sicherlich interessant ist, ist die Vorhersage, welche Medikamente nicht wirken, weil gerade in solchen Fällen kann man sicherlich auch Nebenwirkungen von den Medikamenten, die die Patienten haben, verhindern, indem das vorab schon getestet werden kann. Aber wie gesagt, das ist eine erste Studie mit einem relativ kleinen Patientenkollektiv, und größere Studien und auch unabhängige Studien werden sicherlich nötig sein, um diese Zahlen auch bestätigen zu können.
Blumenthal: Inwieweit können denn solche Tumor-Organoide oder Mini-Tumoren eine Art prädikativer Test sein zur Auswahl oder zum Ausschluss einer Behandlung? Was gibt es da bisher für Erfahrungen?
Boutros: Das sind wirklich Studien, die im Moment laufen, die laufen auch teilweise in Deutschland, diese Verfahren wirklich auch versuchen, diese Autoren sprechen ja von sogenannten so koklinischen (co-clinical) Trials oder koklinischen Versuchen, wo sozusagen parallel zu schon etablierten Behandlungen diese Organoide im Labor gezüchtet werden. Für die Festlegung auf einen prädiktiven Test braucht man natürlich am Ende noch mehr. Und das sind halt wirklich groß angelegte, größer angelegte Studien und nicht sozusagen nur individuelle Studien mit wenigen Patienten, wie sie hier durchgeführt wurden. Und die wichtigen prädiktiven Tests werden letztendlich auch in verschiedenen Orten wiederholt, sodass man ausschließen kann, dass es nicht nur sozusagen eine sehr, sagen wir mal, individuelle Sichtweise der Dinge ist. Ich glaube, das ist hier sehr vielversprechend, wenn ich das zusammenfassen darf, aber es ist sicherlich erst ein Anfang, um das wirklich zu etablieren.
Blumenthal: Was wäre ein notwendiger und erforderlicher weiterer nächster, zweiter Schritt?
Boutros: Ich glaube insgesamt sicherlich die Studien zu vergrößern, die Studien auch an unterschiedlichen Orten durchzuführen, vielleicht auch sozusagen die Medikamententests, die dort durchgeführt wurden, auch etwas zu verbreitern, um letztendlich auch noch einen größeren Überblick zu bekommen.
Nicht unbedingt auf andere Tumore übertragbar
Blumenthal: Und ist es auch eine Frage, an welchen Tumoren man das untersucht, also ob man auch aus anderen Tumoren – Lungenkrebs beispielsweise oder so – solche Organioide züchtet?
Boutros: Das funktioniert vermutlich nicht mit allen Tumoren. Es gibt Tumore, die sehr stark auf das Microenvironment, also die Umgebung der Tumore angewiesen sind, wo auch die Umgebung der Tumore eine sehr, sehr wichtige Rolle spielt, auch in letztendlich der Antwort auf Behandlung, und das lässt sich durch solche Kulturen im Moment nicht besonders gut abbilden, weil man da nur den Tumor hat, aber nicht sozusagen die Umgebung. Dazu gibt es auch Experimente, die durchgeführt werden, wie man auch diese Umgebung sozusagen modellieren kann, auch in solchen Laborversuchen, aber dazu sind sicherlich auch weitere Schritte notwendig.
Anderes Beispiel ist sozusagen die Antwort auch des Immunsystems, die sehr wichtig ist in der Bekämpfung von Tumoren, Immuntherapien, die sich auch sehr schwierig, im Moment zumindest, in diesen Organoid-Kulturen abbilden lassen. Das sind größtenteils auch in dieser Studie gastrointestinale Tumore, die getestet wurden, da bietet sich das sehr an, weil diese Organoide dort auch sehr, sehr gut wachsen. Bei anderen Tumoren wird man sehen müssen, wie gut sich das übertragen lässt.
Blumenthal: Inwieweit eignen sich solche Organoid-Kulturen auch, nicht nur Primärtumore abzubilden, sondern auch beispielsweise Metastasen, als metastasierende Tumore dann abzubilden? Unterscheidet sich ein Primärtumor im Organoid von einem Organoid, das aus Metastasen gewonnen wurde?
Boutros: Im Prinzip vielleicht erst mal nicht. Also auch in dieser Studie wurden durchaus Metastasen angeschaut, die auch in dieser Kultur wachsen konnten, und die Autoren haben das auch verglichen. Und da gibt es in vielen Fällen auch eine ganz gute Übereinstimmung. Das ist aber auch von Tumor zu Tumor sehr unterschiedlich. Im Falle von gastrointestinalen Tumoren scheint es so zu sein, dass man auch aus Metastasen diese Organoide gut gewinnen kann, die dann auch im Labor wachsen und die man im Labor sozusagen für solche Experimente verwenden kann.
Blumenthal: Bei der Tumorbehandlung gibt es ja auch beispielsweise noch Behandlungen, die vor der Entfernung des Tumors dann eingesetzt werden – Chemo oder andere Möglichkeiten. Wie ist es dann eigentlich bei der Anlage von solchen Organoid-Kulturen, kann man die dann noch etablieren, wenn beispielsweise eine Chemobehandlung schon vorausgegangen ist?
Boutros: Teilweise ja und teilweise auch nicht, wenn die Tumore schon sehr stark geschrumpft sind, weil man braucht halt für diese Organoid-Kulturen natürlich schon eine bestimmte Menge an Tumorzellen und Tumormaterial. Wenn die Behandlung vorher sehr erfolgreich war, hat man dann häufig wenig von dem Tumormaterial, und dann gestaltet sich das auch durchaus schwierig, diese Organoide anzulegen. In der Studie sprechen sie – und das deckt sich auch mit vorigen Studien, die zuvor publiziert worden sind –, dass man vielleicht in einer Größenordnung von 70 Prozent aus Biopsien letztendlich diese Organoide zumindest für gastrointestinale Tumoren anziehen kann. Das heißt, es funktioniert auch nicht bei jedem.
Blumenthal: Es gibt eine Möglichkeit, sozusagen individuelle Tumororganoide anzulegen, also Mini-Tumoren von patientenspezifischen Tumoren, aber auch tumortypische Organoide, also das heißt, für einen ganz bestimmten Tumortyp solch einen Mini-Tumor anzulegen. Wo sehen Sie den besseren Weg, wenn man diese Frage so formulieren kann?
Boutros: Ich glaube, das ist im Moment schwierig zu entscheiden. Das sind alles sehr, sehr sozusagen aktiv beforschte Gebiete, das sind wirklich Dinge, die im Moment cutting edge sind, wo die Forschung steht. Meistens sind es noch sehr kleine Kollektive, an denen das durchgeführt wird, und ich glaube, man sollte im Moment einfach beides verfolgen.
Methode könnte am Ende eher Kosten sparen
Blumenthal: Die Frage bei der Tumorbehandlung und bei der Behandlung von Krebs ist ja immer wieder die der Kosten. Was kostet – wenn man das überhaupt schon abschätzen und einschätzen kann –, was kostet solch ein Tumor-Organoid von einem Patienten, also was kommt da auf das System, auf das solidarische System eigentlich zu?
Boutros: Ich glaube, das ist schwierig abzuschätzen. In dieser Studie und auch in anderen Studien sagen die Autoren relativ wenig darüber, aber man muss sich, glaube ich, auch immer darüber klar sein, dass das, was meistens am teuersten ist, sind letztendlich Behandlungen, die nicht wirken. Wenn man hier sozusagen neue Methoden etablieren kann, um nicht wirksame Behandlungen von vornherein auszuschließen, da ist jetzt meine Erwartung, dass diese Methode am Ende eher Kosten spart als sozusagen zusätzliche Kosten verursacht.
Blumenthal: Wann sehen Sie das im klinischen Alltag, diese Tumor-Organoide, wie ist Ihr Blick nach vorn, welche Perspektive sehen Sie da?
Boutros: In kleinen klinischen Studien wird dies angewendet, auch hier in Deutschland, in der Universitätsmedizin Mannheim, werden auch ähnliche Studien durchgeführt, aber es sind natürlich keine Standardbehandlungen, sondern wirklich klinische Testreihen. Und bevor das sozusagen in irgendeiner Art zur Routineversorgung wird, sind sicherlich noch wesentlich größere Studien notwendig, auch noch eine tiefere Charakterisierung auch dieser Tumor-Organoide, wie gut sie mit dem Tumor übereinstimmen, auch ob man zum Beispiel mehrmals Tumor-Organoide von dem gleichen Patienten im Labor entwickeln kann, um zum Beispiel auch zu verstehen, wie sich Resistenzen gegen Medikamente entwickeln und welche neuen Medikamente vielleicht in einer zweiten Linie dann funktionieren können. Und das ist ein sehr, sehr aktiv beforschtes Gebiet, aber sicherlich auch noch ein ganzes Stück weit weg von der klinischen Routineanwendung.
Äußerungen unserer Gesprächspartner geben deren eigene Auffassungen wieder. Der Deutschlandfunk macht sich Äußerungen seiner Gesprächspartner in Interviews und Diskussionen nicht zu eigen.