Ilse Jacobsen ist auf dem Weg zu ihren Versuchstieren, im Keller am Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie in Jena. „Wir gehen jetzt in den Raum, wo wir unsere keimfreien Mäuse züchten", kündigt sie an.
Erstmals wurde diese Sendung am 6.6.2022 ausgestrahlt.
Keimfreie Mäuse. Ein Leben ohne Bakterien, Viren und Pilze. In der Natur kommt so etwas nicht vor. Doch Axel Brakhage, dem Leiter der Arbeitsgruppe, helfen diese unnatürlichen Wesen zu verstehen, wie weit die Keime über unser Leben bestimmen. Klar ist inzwischen: Ohne Mikroben geht es nicht.
„Wir wissen aus Experimenten, wenn man Mäuse steril aufzieht, wenn Mäuse also kein Mikrobiom haben, zum Beispiel im Darm, dass die Defekte haben in verschiedenen Organen, einschließlich des Gehirns", erklärt er.
Moleküle aus dem Mikrobiom
Bakterien und mikroskopisch kleine Pilze produzieren ein ganzes Arsenal von Substanzen, die unseren Stoffwechsel steuern. Sogar Moleküle, die unser Gehirn beeinflussen. Dopamin beispielsweise. Auch an der Bildung des Glückshormons Serotonin sind Darmmikroben beteiligt. Sie produzieren Tryptophan, eine Vorstufe von Serotonin. Außerdem stimulieren Bakterien die Darmwand, damit dort Serotonin produziert wird.
„Wahrscheinlich beeinflusst das Mikrobiom unsere physiologischen Reaktionen wesentlich mehr, als wir bisher wissen. Allein dadurch, dass die Moleküle, die wir ja selbst produzieren, um diese Reaktion zu machen, modifiziert werden durch Mikroorganismen im Mikrobiom; und in vitro gibt es ja schon viele Studien dazu.“
Unser Mikrobiom kann uns aber auch krankmachen. Chronische Entzündungen der Darmwand, Diabetes. Multiple Sklerose, rheumatoide Arthritis, Autismus und sogar psychische Leiden stehen mit Störungen des Mikrobioms in Verbindung. Die Details sind schwer zu entschlüsseln. Viele dieser Untersuchungen zeigen nur: Bei Patienten ist das Gleichgewicht im Darm durcheinandergeraten. Manche Bakterienspezies verschwindet, andere bekommen die Oberhand. Dabei hat die Forschung eines bislang kaum bedacht. Neben den Bakterien gibt es einen weiteren wichtigen Player: Mikroskopisch kleine Pilze. Womöglich sind sie sogar Dirigenten im Mikrobiom.
„Pilze sind für dieses Ökosystem extrem wichtig", sagt dazu Axel Brackhage. "Bestimmte Bakterien inhibieren Pilze, bestimmte Pilze inhibieren bestimmte Bakterien. Aber viele kooperieren auch, um zusammen dann einen sogenannten gemischten Biofilm zu bilden, der dann wieder schützt vor pathogenen Mikroorganismen.“

Pilze: nahezu unerforscht
Mit den Pilzen war das Schicksal der Erde schon verwoben, lange bevor die Evolution die ersten Säugetiere hervorbrachte. „Es gibt keine Welt ohne Pilze, und zwar einfach deshalb, weil mehr als 80 Prozent der Pflanzen Pilze zum Wachsen brauchen. Für die Sauerstoffproduktion sind Pilze essenziell, weil sie eben diese Pflanzen unterstützen und die Pflanzen ja zusammen mit Algen im Meer dazu führen, dass genug Sauerstoff produziert wird. Sonst hätten wir eine anaerobe Welt.“
Eine Welt, regiert von Bakterien und Archaeen. Die längste Zeit der Erdgeschichte war das der Fall. „Und dadurch, dass wir Sauerstoff in die Welt bekommen haben, konnten überhaupt erst komplexere Organismen sich entwickeln, weil wir jetzt viel mehr Energie gewinnen können. Pilze sind ja auch Eukaryoten. Das heißt, die konnten dann wieder die Pflanzen unterstützen, die dann noch mehr Sauerstoff produzierten. Es gibt viele Substanzen auf der Welt, die keiner mehr abbauen könnte. Bestimmte ökologische Funktionen, die können nur Pilze übernehmen. Ohne Pilze würde der ökologische Kreislauf stoppen auf der Welt.“
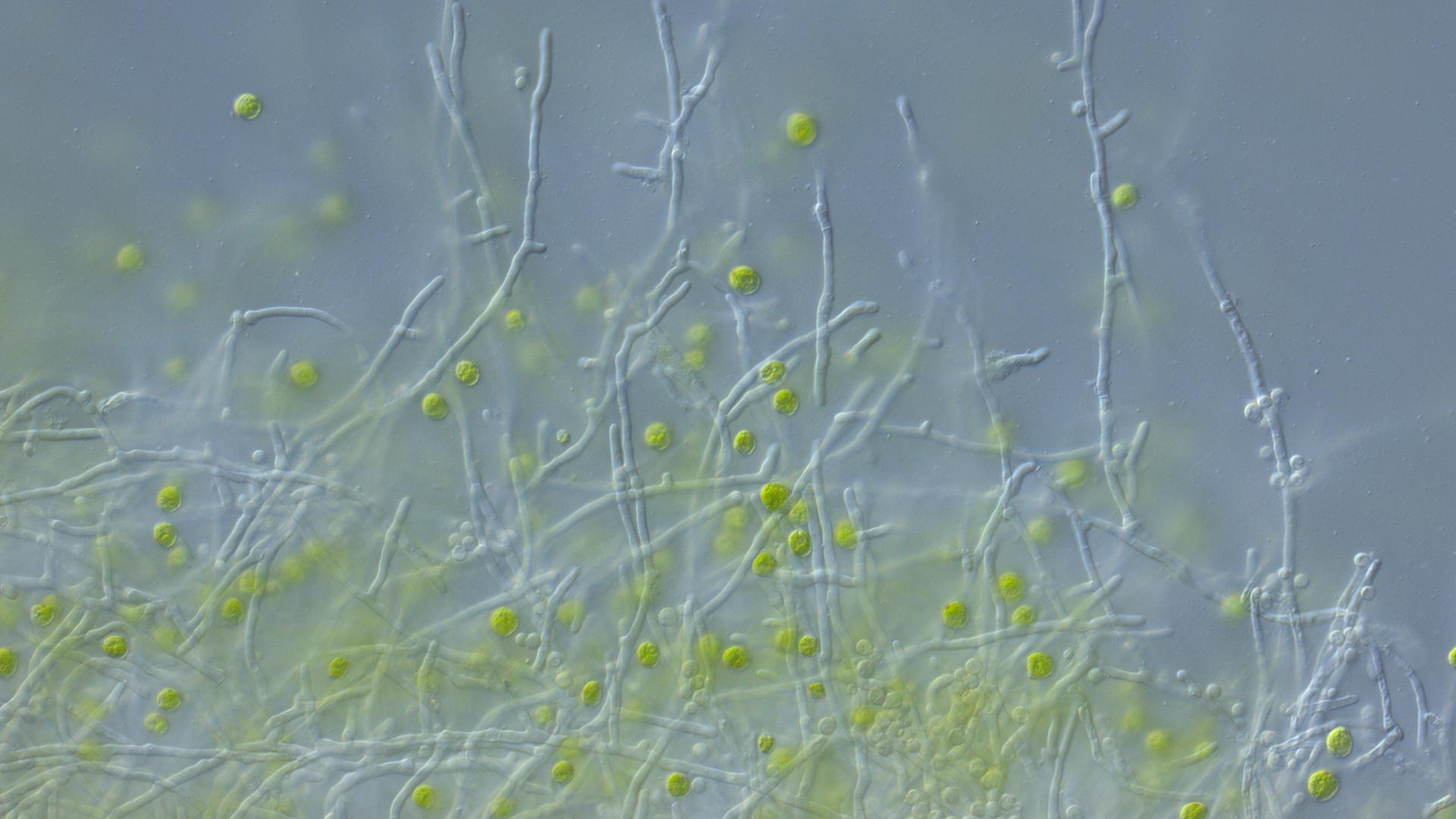
Pilzzellen sind deutlich größer als Bakterien und sie sind komplizierter aufgebaut, erklärt Marco Thines, Gruppenleiter am Senckenberg Biodiversitäts- und Klimaforschungszentrum in Frankfurt am Main. Er ist einer der wenigen Forscher in Deutschland, die sich ausschließlich mit Pilzen beschäftigen.
„Besonders spannend finde ich, dass sie die dritte Säule von Ökosystemen darstellen, aber nahezu gar nicht erforscht sind, wenn man das vergleicht beispielsweise mit Tieren und Pflanzen. Nur um ein Beispiel zu nennen: Bei Säugetieren oder Wirbeltieren im Allgemeinen und bei höheren Pflanzen, also Blütenpflanzen, kennt man in Deutschland eigentlich mindestens 99 Prozent der Arten. Bei Pilzen und Oomyceten, also Scheinpilzen, kennt man wahrscheinlich erst ungefähr fünf bis zehn Prozent der Arten.“
Mensch mit Pilzen enger verwandt als mit Bakterien
Beim Blick auf den Stammbaum fällt auf: Der Ast der Pilze ist unserem wesentlich näher als der von Bakterien oder anderen Einzellern. Wir sind also enger mit Pilzen verwandt als mit Bakterien. Gleichzeitig sind sie uns aber weniger vertraut.
„Zumindest, wenn sie im Boden wachsen, dann sieht man sie eben nicht. Von den Pilzen sieht man die Fruchtkörper ja eigentlich nur zu wenigen Zeiten des Jahres. Das wäre so, als wenn man von einem Apfelbaum nur ab und zu mal die Äpfel sieht. Dann würde man vielleicht auch gar nicht verstehen, was für eine Bedeutung der Baum als Ganzes haben kann. Die Pilze leben halt meistens im Verborgenen und viele der Pilze lassen sich auch nicht so einfach ins Labor holen oder in irgendwelchen Versuchsaufbauten so einfach studieren, wie das beispielsweise bei Pflanzen oder bei Tieren der Fall ist.“
Auch Oliver Kurzai, Vorstand des Instituts für Hygiene und Mikrobiologie am Universitätsklinikum Würzburg, forscht auf diesem Gebiet: „Dass Pilze in der Lage sind, sich zu ernähren, also Nährstoffe zu beschaffen, ohne dass sie sich bewegen können, das gibt es sonst eigentlich nicht in der Natur. Der Pilz ist einfach nur da, hat keine aktive Beweglichkeit und kann durch ganz spezielle Enzyme, die er in die Umgebung abgibt, quasi außerhalb seines Gewebes verdauen und dann die Nährstoffe aufnehmen. Total cool!“
Der Pinselschimmel Penicillium zum Beispiel gibt Substanzen ab, die im Waldboden Zellulose abbauen. Er produziert aber auch ein Antibiotikum, das Bakterien in Schach hält, das Penicillin. In der Medizin nutzen wir heute etliche Substanzen aus dem Köcher von Pilzen: Statine etwa, die beim Menschen den Cholesterinspiegel senken. Oder Zyklosporin, ein Medikament, das Menschen nach Organtransplantationen einnehmen. Es unterdrückt das Immunsystem und verhindert, dass der Körper das fremde Organ abstößt.
„Die Fähigkeit von Pilzen, unser Immunsystem zu stimulieren, ist wirklich eins der Forschungsthemen momentan", sagt Oliver Kurzai. "Wir lernen zunehmend, dass Pilze bestimmte Substanzen bilden, die Bakterien normalerweise nicht bilden, und die eine ganz eigenartige und wichtige Eigenschaft haben, unser Immunsystem zu stimulieren. Und da lernen wir gerade erst total spannende Sachen.“
Sprache der Mikroben entziffern
Doch warum produzieren Pilze so viele Substanzen, die auch den menschlichen Organismus beeinflussen? Sogar sein Gehirn? „Das weiß man inzwischen auch schon durch chemische Analysen, dass einige Pilze zum Beispiel Neurotransmitter produzieren", sagt Axel Brakhage. "Das heißt, sie sind bei uns im Darm und beeinflussen unser Nervensystem und wie wir reagieren.“
Eine plausible Antwort: Pilze produzieren all diese Stoffe, weil sie eben nicht nur im Waldboden zuhause sind, sondern auch in uns. Sie und wir bilden zusammen mit den anderen Mikroben eine Gesellschaft. Erbgutanalysen belegen: Allein im menschlichen Darm leben bis zu 1.400 unterschiedliche Mikrobenarten auf engstem Raum zusammen. Bakterien, Pilze, Archaeen, die früher Urbakterien genannt wurden, und Viren. Sie konkurrieren um Nahrung, Platz und Einfluss im Mikrobenfilz. Das Wechselspiel ist extrem komplex. Doch es gibt Wege, ihnen bei der Arbeit zuzusehen.
„Diese Organismen interagieren miteinander und diese Interaktion erfolgt über die Sprache der Mikroorganismen. Die Sprache der Mikroorganismen sind kleine Moleküle, die ausgetauscht werden.“ In diesen Substanzen sind Botschaften enthalten, so Axel Brakhage. „Und dadurch wissen andere Mikroorganismen: ‚Ich gehe lieber weg‘, wenn es Moleküle sind, die ein bisschen antibiotisch wirken. Oder es sind Moleküle, die sie sogar anziehen, attrahieren. Das heißt, es gibt verschiedene Interaktionssysteme zwischen den Mikroorganismen, das kann antagonistisch sein: ‚Geh weg!‘ Oder sie sagen: ‚Komm her, wir können zusammen einen Mehrwert erzeugen.‘“
Über dieses ausgeklügelte Wechselspiel halten sich die Mikroben gegenseitig in Schach. Nach einer Antibiotikakur vermehren sich manche Mikroben unkontrolliert und verdrängen andere. Es kommt zu Missklängen – unter Umständen mit weitreichenden Konsequenzen. Denn die Stoffwechselprodukte der Bakterien und Pilze beeinflussen unseren gesamten Organismus.
„Es ist zum Beispiel eine schöne Hypothese zu erklären, warum Choleriker Choleriker sind: Weil sie ein bestimmtes Mikrobiom haben und die Substanzen, die dazu führen, dass der Choleriker ein Choleriker ist, nicht genügend abbauen. Das sind so die Interaktionen, die wir mit dem Mikrobiom haben.“
"Verstehen" Pilze Bakterien - und umgekehrt?
In Jena, am Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie, hat man sich die Mammutaufgabe gestellt, die biochemischen Gespräche der Mikroben zu entziffern. Denn Axel Brakhage vermutet darin den Schlüssel zum Verständnis chronischer Krankheiten, einschließlich psychiatrischer Störungen. In den Laboren bringt sein Team die Mikroorganismen zum Sprechen.
Zwei Menschen stehen mit einer Pipette bewaffnet an einer sogenannten „Clean Bench“. Es ist ein großer Tisch mit Abzugshaube, auf dem verschiedene Glasgefäße und Geräte stehen. „Das ist Herr Krespach, der promovierte bei mir, und das ist eine Doktorandin von mir, Maira Rosin", stellt Axel Brakhage sie vor.
Um den Keimen Botschaften zu entlocken, setzen sie einzelne Pilzarten mit einzelnen Bakterien in eine Versuchsarena. „Und da co-kultivieren wir Mikroorganismen und fragen: Sprechen die miteinander? Indem sie bestimmte Reaktionen zeigen und so etwas. Das nennen wir funktionelle Mikrobiomforschung. Das heißt, die Frage: Wer bestimmt die Zusammensetzung eines Mikrobioms - ganz im Kleinen?“
Die Botschaften, die sich Pilze und Bakterien bei ihren Rendezvous zusenden, können nur sehr teure Geräte aufzeichnen. „Wir können ja mal zur LC/MS gehen", sagt Brakhage. "Was wir machen, wir co-kultivieren hier nur und machen PCR und all so ein Zeug, und dann werden wir die Metaboliten analysieren."
Und was sagt Ihnen diese Sprache jetzt?
Die LC/MS-Anlage steht im Nachbarlabor. Ein weißes Metallungetüm, das leise vor sich hin brummt. LC/MS steht für Flüssigchromatografie mit Massenspektrometrie-Kopplung. „Wenn ich zu Ihnen spreche, sprechen Sie zu mir zurück, das heißt: Sie reagieren damit, dass sie sprechen. So ist das bei Mikroorganismen oft auch, dass sie dann Moleküle produzieren. Diese Moleküle Identifizieren wir mithilfe von massenspektrometrischen Analysen und können dann rausfinden: Was sind das für Moleküle, zum Teil sind das auch neue Moleküle?“
Ein Diagramm erscheint auf dem Computerbildschirm. Es zeigt lange Linien mit einzelnen Peaks. Darunter stehen kleine Buchstaben. Was sagen die dem Forscher? „Wie diese Mikroorganismen interagieren. Bei uns ist es zum Beispiel der Fall, dass der Pilz normalerweise ganz entspannt wächst und nicht so viele Signalmoleküle produziert von sich alleine. Das kann man hier sehen, das sieht relativ leer aus, das Diagramm.“
Auf dem Bildschirm sind nur wenige Peaks zu erkennen. „Jeder Peak entspricht einem Stoff und in der Kultur alleine produziert er nicht so viele Peaks, nicht so viele Stoffe. Wenn wir ihn dann zum Beispiel mit einem Bakterium zusammensetzen, dann werden gezielt bestimmte Stoffe produziert. Dann entstehen zum Beispiel hier diese einzelnen verschiedenen Peaks, die alleine nicht produziert werden.“
Die beiden Mikroorganismen, deren Gespräche Maira Rosin hier belauscht, sind der Pilz Aspergillus nidulans und das Bakterium Streptomyces iranensis. „Und nur die beiden machen das. Das heißt, Aspergillus reagiert in dieser Art nur auf diesen Streptomyceten, auf dieses Bakterium, das wir identifiziert haben von 50 anderen. Unter 50 anderen Bakterien haben wir den Partner gefunden, mit dem der Pilz spricht. Und die Substanzen, die produziert werden, die sind hoch interessant. Wir wissen aber inzwischen auch die Substanz des Bakteriums, die Aspergillus versteht und die dem Pilz sagt: Mach jetzt auch Substanzen und sprich mit mir; die ich Ihnen nicht nennen darf, wir haben die patentiert. So können wir aus diesen Organismen auf der einen Seite verstehen lernen, wie die sprechen, auf der anderen Seite aber auch neue Substanzen entdecken.“
Das Ziel: gestörtes Mikrobiom wieder ins Lot bringen
Zehn Jahre haben die Forschenden gebraucht, bis sie diese beiden Mikroben gefunden hatten, zwischen denen die Chemie stimmt. Bleibt es bei diesem Tempo, würde es bestenfalls Jahrhunderte dauern, bis alle Botschaften zwischen Pilzen und Bakterien entschlüsselt wären. Dabei mischen noch weitere Mikroorganismen mit: Viren und Archaeen. Über ihren Einfluss ist noch so gut wie gar nichts bekannt, und auch dann muss man die Botschaft des Mikrobioms noch begreifen.
„Die große Frage ist ja dann wirklich: Wenn man die kleinen Teile versteht, ob man dann das Gesamtsystem verstehen kann. Und dann gibt es ja doch einige Zweifel, sodass wir dazu kommen müssen, dann, wenn wir die kleineren Teile verstanden haben, dass wir dann anfangen zu verstehen, wie fügen sie sich ein und wie generieren die wahrscheinlich einen Mehrwert, wenn die zu mehreren sind. Aber um grundlegendes Verständnis zu erzeugen, muss man reduktionistisch sein. Wie wollen Sie sonst 1000 Spezies mal zig Millionen Individuen dieser Spezies plus Immunsystem plus Millionen von oder Tausenden von verschiedenen Molekülen, die das beeinflussen, sonst verstehen lernen? Es ist nicht trivial.“
Langfristiges Ziel ist, das gestörte Mikrobiom kranker Menschen zu korrigieren. Doch Versuche, einzelne verlorengegangene Bakterienspezies zu ersetzen, hatten bislang wenig Erfolg. Womöglich reicht es aber auch, nur ein paar der wichtigen Strippenzieher zu kennen: Axel Brakhage vermutet, dass vor allem Pilze mit ihren Stoffwechselprodukten zu den Schlüsselorganismen gehören.
„Das heißt, es wird ganz wichtig für uns zu verstehen: Wen braucht man, um so ein Mikrobiom zu strukturieren? Und was sind diese Mikroorganismen, die wirklich das bestimmen? Wie wenn sie in ein Fußballstadion gehen? Sie haben 60.000 Zuschauer. Wo ist derjenige, der vielleicht sagt, dass jetzt die eine Mannschaft angefeuert werden muss? Wenn wir das verstehen würden, dann haben wir die Chance, ein gesundes Mikrobiom wiederherzustellen.“
Von der Petrischale zum lebenden Organismus
Im Labor haben Axel Brakhage und sein Team bereits Pilz-Kandidaten identifiziert, die das Zeug dazu hätten, die gesamte Mikrobiom-Mannschaft anzufeuern. Noch ist unklar, ob sie im lebenden Organismus dieselben Führungsqualitäten entfalten wie im Labor. Deshalb beimpfen die Forschenden im nächsten Schritt Versuchstiere mit einzelnen Bakterien- und Pilzarten. „Das kann man in solchen Modellen, die man steril macht und dann langsam besiedelt, erst mit einer Spezies, dann mit einer anderen. Das ist so die Zukunft, wie man so etwas untersuchen kann.“
Am Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie arbeitet Ilse Jacobsen mit solchen Tiermodellen. Sie ist Immunologin und beschäftigt sich vor allem mit Mikroorganismen, die den Menschen krankmachen können. Für ihre Versuche nutzt sie Mäuse ohne eigenes Mikrobiom. Wer die keimfreien Mäuse besuchen möchte, muss die gesamte Kleidung gegen einen weißen Laborkittel mit passender Hose austauschen.
„Ich habe mich umgezogen und Handschuhe angezogen. Jetzt gehen wir zur nächsten Schleuse", sagt Jacobsen. "Hier müssen wir uns noch mal umziehen.“ In dieser zweiten Schleuse wartet auf den Besucher ein gelber Ganzkörper-Overall. Die Haare verschwinden unter einem Netz. Mit dieser aufwändigen Prozedur stellen die Forscher sicher, dass so wenig Mikroben wie möglich ins Labor gelangen. Dann geht es ins eigentliche Keimfreilabor.
„Ich habe mich umgezogen und Handschuhe angezogen. Jetzt gehen wir zur nächsten Schleuse", sagt Jacobsen. "Hier müssen wir uns noch mal umziehen.“ In dieser zweiten Schleuse wartet auf den Besucher ein gelber Ganzkörper-Overall. Die Haare verschwinden unter einem Netz. Mit dieser aufwändigen Prozedur stellen die Forscher sicher, dass so wenig Mikroben wie möglich ins Labor gelangen. Dann geht es ins eigentliche Keimfreilabor.
Auf den ersten Blick ein normales Versuchslabor. Weiß gestrichene Wände, ungemütliche Deckenbeleuchtung. In der Mitte des Raums stehen große, durchsichtige Boxen. Sie wirken futuristisch. „Das, was Sie hier haben, sieht so ein bisschen aus wie überdimensionierte Brutschränke, die man von Frühchenstationen kennt.“ In diesen Behältern könnten sich allerdings auch ausgewachsene Menschen ausstrecken.

Experimente mit keimfreien Mäusen
„Tatsächlich ist alles, was in diesen Plastikverpackungen drin ist, keimfrei. Und darin leben - ich mach das hier mal zur Seite - unsere Mäuschen. In ganz normalen Käfigen, mit einem speziellen Futter, wo besonders viele Vitamine drin sind, weil die ja keine Mikroorganismen haben, die im Darm die Vitamine produzieren.“
An den Seiten befinden sich kreisrunde Öffnungen, etwa so groß wie Autoreifen. Sie sind mit Plastik abgedichtet. In der Mitte ragen Gummihandschuhe wie große Nasen hervor. „Und wenn wir uns die jetzt anschauen wollen, dann können wir da nicht normal anfassen, auch nicht mit Handschuhen, sondern wir müssen durch diese speziellen Handschuhe gehen. Ich mache das mal in einem Fall vor.“
Ilse Jacobsen taucht mit ihren Händen ein. „Da können wir auch mal einen Käfig nach vorne holen, wo also das Innere immer nur im Inneren bleibt - und damit keimfrei ist.“ Die Finger stecken schon in Plastikhandschuhen. Jetzt verschwinden sie in den vorgeformten Gummihandschuhen.
"Auf den ersten Blick sehen die Mäuse aus wie ganz normale Mäuse", sagt Jacobsen. „Man sieht ihnen nicht an, dass sie kein Mikrobiom haben und solange sie in ihrer sterilen Umwelt leben, passiert ihnen auch nichts, solange wir sie mit dem richtigen Futter füttern. Wenn wir sie jetzt aber einfach unkontrolliert rausnehmen würden, dann hätten sie aufgrund des nicht ausgereiften Immunsystems ein sehr hohes Infektionsrisiko. Gut, dann schauen wir uns mal die Tiere an, die nicht mehr keimfrei sind.“
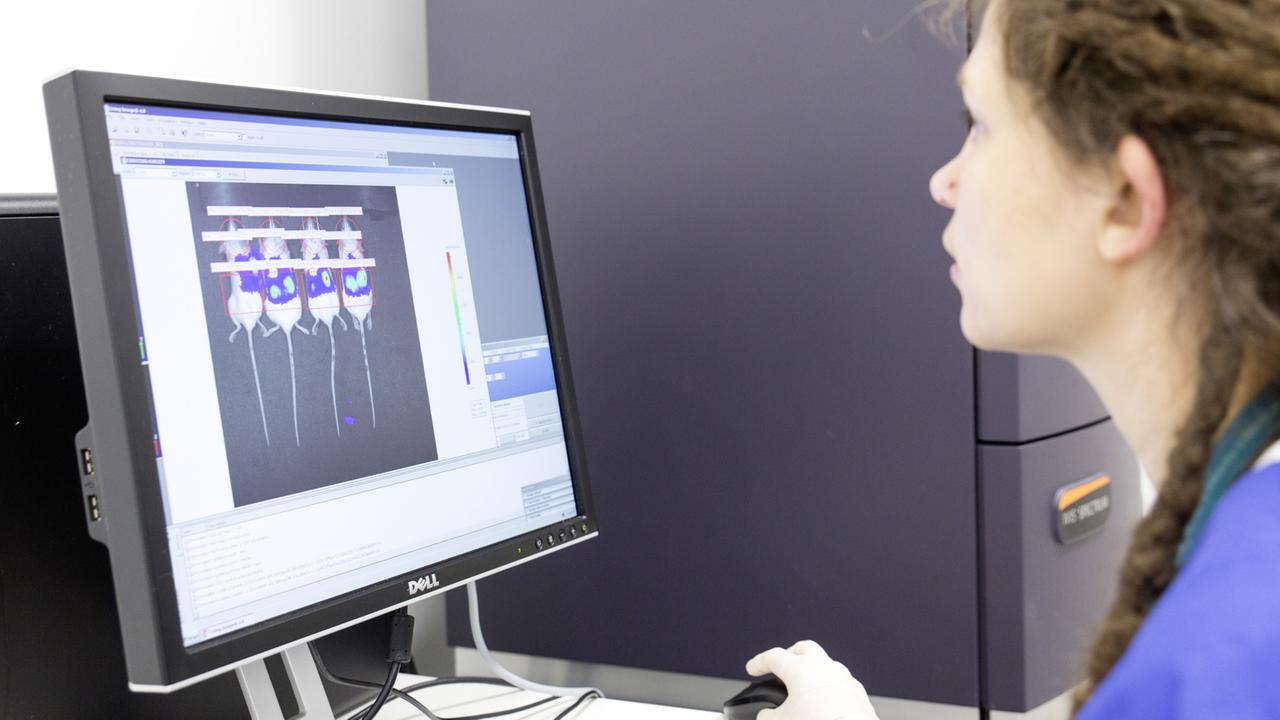
Gute Kontakte, schlechte Kontakte
Um herauszufinden, wie einzelne Mikrobenarten im Körper aufeinander reagieren, werden die Mäuse gezielt mit diesen Keimen beimpft. Im Nachbarraum steht ein hohes Regal an der Wand. Darin nebeneinander aufgereiht durchsichtige Plastikhäuschen mit jeweils zwei Mäusen darin.
"Das sind jetzt Tiere, die ab Geburt mit genau einer Art Bakterium besiedelt sind, in dem wir die Eltern - die Eltern waren keimfrei - mit diesem Bakterium besiedelt haben. Die haben das Bakterium von ihren Eltern bekommen - und mit denen wollen wir jetzt untersuchen, ob dieses Bakterium die Kolonisierung durch unseren Pilz reduzieren kann.“
Aus ihren Tests wissen Ilse Jacobsen und ihr Team: Wenn die Bakteriengemeinschaft gestört ist, beginnen bestimmte Pilzarten unkontrolliert zu wachsen. Fehlt einer der Partner, ergreift der andere also die Chance, den Platz des anderen zu übernehmen. Das deutet an, dass sich Bakterien und Pilze gegenseitig in Schach halten. Sehr wahrscheinlich über Moleküle, mit denen sie das Wachstum des anderen bremsen. Dieses Wissen könnte helfen, Infektionen mit solchen Keimen zu behandeln.
"Die Frage, die sich gestellt hat, ist, ob die beiden sich negativ beeinflussen, und damit kein erhöhtes Risiko für eine Infektion ist. Oder, ob die vielleicht positiv miteinander interagieren und das Risiko erhöhen. Wir haben festgestellt: Für manche Bakterien ist es so, dass beide zusammen - Bakterien plus Pilz - sehr viel mehr Schädigung bei Wirtszellen auslösen, als wenn sie alleine sind. Das bedeutet ein erhöhtes Risiko für eine Infektion.“
Candida-Pilz aktiviert Immunsystem
Welche der unzähligen Mikroben bekämpft man also – und wen lässt man besser durch? Denn klar ist inzwischen auch: Unsere körpereigene Abwehr entscheidet mit darüber, wer es sich in unserem Darm bequem machen darf. Um in der mikrobiellen Welt nicht unterzugehen, hat der Mensch ein ausgeklügeltes Immunsystem entwickelt.
„Da gibt es Theorien, das gibt es eigentlich und ist gereift, weil es Mikroorganismen in der Umwelt gibt", erläutert Axel Brakhage. Der Mensch musste seine Körperzellen gegenüber Bakterien und Pilzen abgrenzen und hat sich dabei mit einigen Einzellern arrangiert. Freundschaften sind entstanden, oftmals sogar Abhängigkeiten. Bakterien oder Pilze aus dem Darm zu entfernen, kann die Netzwerke empfindlich stören. Das Immunsystem dagegen hat eigene Wege gefunden, Schmarotzer von Freunden zu unterscheiden. Es erkennt Mitglieder des Mikrobioms an spezifischen Strukturen. „Das zeigt sich einfach daran, dass wir inzwischen wissen, dass wir viele Rezeptoren haben auf unseren Immunzellen, die ganz spezifisch Pilzmoleküle auf der Oberfläche erkennen.“
Mit diesen Pilz-Rezeptoren hat sich Petra Bacher beschäftigt. Sie forscht am Institut für Immunologie des Universitätsklinikums Schleswig-Holstein. „Zum Beispiel gibt es einen Pilz, der heißt Candida albicans. Das ist ein Pilz, der bei jedem im Darm vorkommt. Da konnten wir zeigen, dass das ein ganz zentraler Modulator von menschlichen Immunreaktionen ist.“
Petra Bacher hat beobachtet, dass dieser Candida-Pilz bestimmte Immunzellen aktiviert, so genannte TH-17 Zellen. Diese T-Helferzellen spielen unter anderem bei der Entstehung chronischer Entzündungen und Autoimmunerkrankungen eine Rolle. Möglicherweise verhindert der Kontakt mit dem Candida-Pilz, dass das Immunsystem überreagiert. "So kann man sich vorstellen, dass eigentlich diese Besiedelung mit Pilzen und auch anderen Mikroben ganz zentral ist, um unser Immunsystem zu erziehen, sozusagen.“
Mikrobiom beeinflusst Denken und Verhalten
Seit ein paar Jahren verdichten sich die Hinweise, dass sich unser Immunsystem von Geburt an mit seinen körpereigenen Bakterien auseinandersetzen muss, um nicht fehlgeleitet zu werden. Geht bei dieser Prägung etwas schief, kann es zu Allergien oder sogar zu Autoimmunerkrankungen kommen. Offenbar gilt diese frühe Weichenstellung nicht nur für Bakterien.
„Letztendlich ist es für die Pilze eigentlich genau das gleiche. Auch diese Besiedelung zum Beispiel mit diesem Candida-albicans-Pilz beginnt bei der Geburt und dann findet ja schon einmal die erste Interaktion mit dem Immunsystem statt, und da haben, denke ich, auch Pilze eine ganz große Rolle, auch bei dieser ersten Prägung, auch der Immunantwort, aber eben auch später. Das heißt, selbst im Erwachsenenalter hat man diese Pilze noch, diese wahrscheinlich dauerhafte Interaktion. Das hält auch irgendwo das Immunsystem sozusagen in Schuss und generiert eben weiter diese Antworten.“
Immer deutlicher zeichnet sich ab: Säugetiere sind auch mit ihren Pilzen eng verstrickt. Mäuse, die mit bestimmten Pilzen kolonisiert sind, verhalten sich sozialer als Artgenossen ohne Pilze, und eine Besiedelung mit dem Pilz Candida albicans lässt den Stresspegel ansteigen. Es sind neue Puzzleteile: Wir, das sind nicht nur unsere Zellen und Organe, sondern auch all die kleinen Organismen unseres Mikrobioms, zu dem auch die Pilze gehören. Bei keimfreien Tieren kommt es zu Entwicklungsstörungen. Selbst das Gehirn ist betroffen - und mit ihm Denken und Fühlen.
Frage an Axel Brakhage: „Muss man vielleicht auch drüber nachdenken, ob der Mensch wirklich so dieses individuelle Wesen ist, als das er sich immer so wahrnimmt?“ - „Ich weiß nicht. In Ihrer Sendung kann ich mich dazu nicht äußern, aber die Frage ist ja: Gibt es einen freien Willen? Vielleicht machen die Bakterien unseren Willen, indem sie uns beeinflussen über unsere Hormone. Aber das will ich jetzt... Also das ist eine echt tolle Diskussion. Aber vielleicht ist der freie Wille nur eine durch Neurotransmitter gesteuerte Entscheidungs- eine stochastische Aktivierung, die von Mikroorganismen beeinflusst wird. Schreiben Sie das bitte nicht... Ich möchte das nicht sagen. Da bin ich als Wissenschaftler... Das ist schon ein bisschen weit, aber ich meine, das wird die Zukunft zeigen.“
Verblüffendes Potenzial, großer Forschungsbedarf
Schon jetzt deuten Experimente an, dass der Arm der Mikroben sehr weit reicht. Keimfreie Mäuse, denen die Mikroben fettleibiger Menschen eingepflanzt wurden, entwickelten ebenfalls Adipositas. Das Mikrobiom junger Mäuse kann bestimmte Alterungserscheinungen umkehren. Die Keime menschlicher Sportler lassen Versuchstiere länger im Laufrad durchhalten, und möglicherweise werden auch negative Erfahrungen über die Darmkeime weitergegeben.
Für Menschen ist diese mikrobielle Durchschlagkraft zwar bislang nicht belegt. Doch es hat sich gezeigt: Patienten, bei denen das Bakterium Chlostridium difficile chronische Durchfallerkrankungen hervorruft, hilft eine Mikrobenspende von Gesunden. Die Wirkung solcher Stuhltransplantationen sei verblüffend, sagt Axel Brakhage.
"Die Frage ist natürlich jetzt: Was wurde mit dem Stuhl transplantiert, damit wieder sich ein Mikrobiom gebildet hat in diesen kranken Patienten, das verhindert, dass sich wiederum Chlostridium difficile dort festsetzen kann? Und da müssen wir eben die rationalen Grundlagen dafür schaffen. Wir müssen das verstehen lernen. Wenn wir das verstehen würden, dann haben wir die Chance, ein gesundes Mikrobiom wiederherzustellen.“
Die Aufgabe der Forschung wird es nun sein, die komplizierten Beziehungen der Mikroben weiter auseinanderzudividieren. Sie muss verstehen lernen, mit welchen Molekülen sich die Keime gegenseitig beeinflussen und wie ihre Stoffwechselprodukte unseren Organismus steuern. Mit den Pilzen ist dieser Mikrobenfilz für die Forschung noch einmal unübersichtlicher geworden. Wir kommen der Gesellschaft in uns aber auch ein gutes Stück näher.