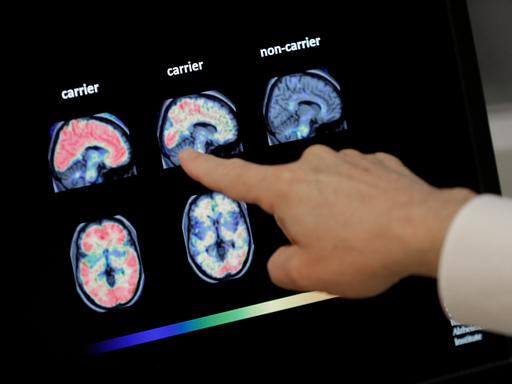
„Also der Patient kommt alle zwei Wochen zu uns zu einer Antikörper-Infusion gegen ein pathologisches Eiweiß, das bei der Alzheimer-Krankheit eine Rolle spielt.“
Zentrum für kognitive Störungen der Technischen Universität München, Europas älteste Gedächtnisambulanz, November 2021. Die Ärztin Bianca Dorn versucht sich um jeden Patienten zu kümmern. Erkundigt sich nach dem Befinden, nimmt sich Zeit für ein kurzes Gespräch. Auch wenn ihre Patienten nur da sind, um ihre regelmäßige Infusion zu bekommen.
So wie Jürgen Winter. Er ist Mitte siebzig. Körperlich ist er fit. Doch er leidet an einer Alzheimer-Demenz. Im Rahmen einer Studie erhält er in der Ambulanz ein neues Medikament. „Also das war eigentlich wirklich für mich überhaupt keine Überwindung, möchte ich mal so sagen. Nicht? Jetzt da irgendwo eine Studie zu machen. Sondern es war mir ein Bedürfnis.“
Bianca Dorn: „Und was ich aus ärztlicher Sicht sagen kann ist, dass wir natürlich über die lange Zeit eine sehr enge Beziehung auch zum Patienten aufbauen, weil wir die natürlich alle zwei Wochen sehen und auch eigentlich so die Familienmitglieder, oder man sagt dann immer den 'Caregiver', also die Bezugsperson in der Studie dann auch hin und wieder kennenlernen oder mit denen reden. Das bereitet uns hier im Zentrum allen sehr große Freude.“
Zentrum für kognitive Störungen der Technischen Universität München, Europas älteste Gedächtnisambulanz, November 2021. Die Ärztin Bianca Dorn versucht sich um jeden Patienten zu kümmern. Erkundigt sich nach dem Befinden, nimmt sich Zeit für ein kurzes Gespräch. Auch wenn ihre Patienten nur da sind, um ihre regelmäßige Infusion zu bekommen.
So wie Jürgen Winter. Er ist Mitte siebzig. Körperlich ist er fit. Doch er leidet an einer Alzheimer-Demenz. Im Rahmen einer Studie erhält er in der Ambulanz ein neues Medikament. „Also das war eigentlich wirklich für mich überhaupt keine Überwindung, möchte ich mal so sagen. Nicht? Jetzt da irgendwo eine Studie zu machen. Sondern es war mir ein Bedürfnis.“
Bianca Dorn: „Und was ich aus ärztlicher Sicht sagen kann ist, dass wir natürlich über die lange Zeit eine sehr enge Beziehung auch zum Patienten aufbauen, weil wir die natürlich alle zwei Wochen sehen und auch eigentlich so die Familienmitglieder, oder man sagt dann immer den 'Caregiver', also die Bezugsperson in der Studie dann auch hin und wieder kennenlernen oder mit denen reden. Das bereitet uns hier im Zentrum allen sehr große Freude.“
In der Infusion ist der neue Wirkstoff - oder aber ein Placebo
Vor knapp 10 Jahren bemerkte Jürgen Winter, dass sein Gedächtnis schlechter wird. In seiner Familie waren schon häufiger Demenzerkrankungen aufgetreten. Doch Ärzte konnten bei ihm zu diesem Zeitpunkt noch keine Anzeichen erkennen. Als er in den Ruhestand geht, häufen sich die Erinnerungslücken. Er lässt sich erneut untersuchen: Die Diagnose: Alzheimer-Demenz.
Er hat eine Partnerin, mit der er nicht zusammenlebt. Aber im Alltag kommt er allein meist noch gut zurecht. In der Studie sieht er seine Chance: "Das hoffe ich ja, dass das durch das Medikament wenigstens angehalten wird, nicht? Dass es dann wirklich in dem Status bleibt, wie ich jetzt bin. Weil das könnte ich noch alleine gut managen.“
Das Medikament, das Jürgen Winter hier anspricht, ist Lecanemab. Ein ähnliches Präparat wie Aducanumab, das die Zulassungsbehörde FDA, gerade erst für den US-amerikanischen Markt freigegeben hat. Jürgen Winter hat davon gehört. Doch in Europa ist Aducanumab im November 2021 noch nicht zugelassen.
Jürgen Winter bekommt alle zwei Wochen eine Infusion mit Lecanemab – oder einem wirkstofflosen Placebo. Das wissen Jürgen Winter und die behandelnden Ärzte zum jetzigen Zeitpunkt noch nicht. „Na gut, dann würde ich mich jetzt mal wieder verabschieden. Und wie gesagt, das wird jetzt so. In einer Stunde fängt so ein bisschen das Piepsen an, weil dann eben, wenn die Infusion durch ist, noch so eine Spülflüssigkeit angehängt wird.“
Er hat eine Partnerin, mit der er nicht zusammenlebt. Aber im Alltag kommt er allein meist noch gut zurecht. In der Studie sieht er seine Chance: "Das hoffe ich ja, dass das durch das Medikament wenigstens angehalten wird, nicht? Dass es dann wirklich in dem Status bleibt, wie ich jetzt bin. Weil das könnte ich noch alleine gut managen.“
Das Medikament, das Jürgen Winter hier anspricht, ist Lecanemab. Ein ähnliches Präparat wie Aducanumab, das die Zulassungsbehörde FDA, gerade erst für den US-amerikanischen Markt freigegeben hat. Jürgen Winter hat davon gehört. Doch in Europa ist Aducanumab im November 2021 noch nicht zugelassen.
Jürgen Winter bekommt alle zwei Wochen eine Infusion mit Lecanemab – oder einem wirkstofflosen Placebo. Das wissen Jürgen Winter und die behandelnden Ärzte zum jetzigen Zeitpunkt noch nicht. „Na gut, dann würde ich mich jetzt mal wieder verabschieden. Und wie gesagt, das wird jetzt so. In einer Stunde fängt so ein bisschen das Piepsen an, weil dann eben, wenn die Infusion durch ist, noch so eine Spülflüssigkeit angehängt wird.“

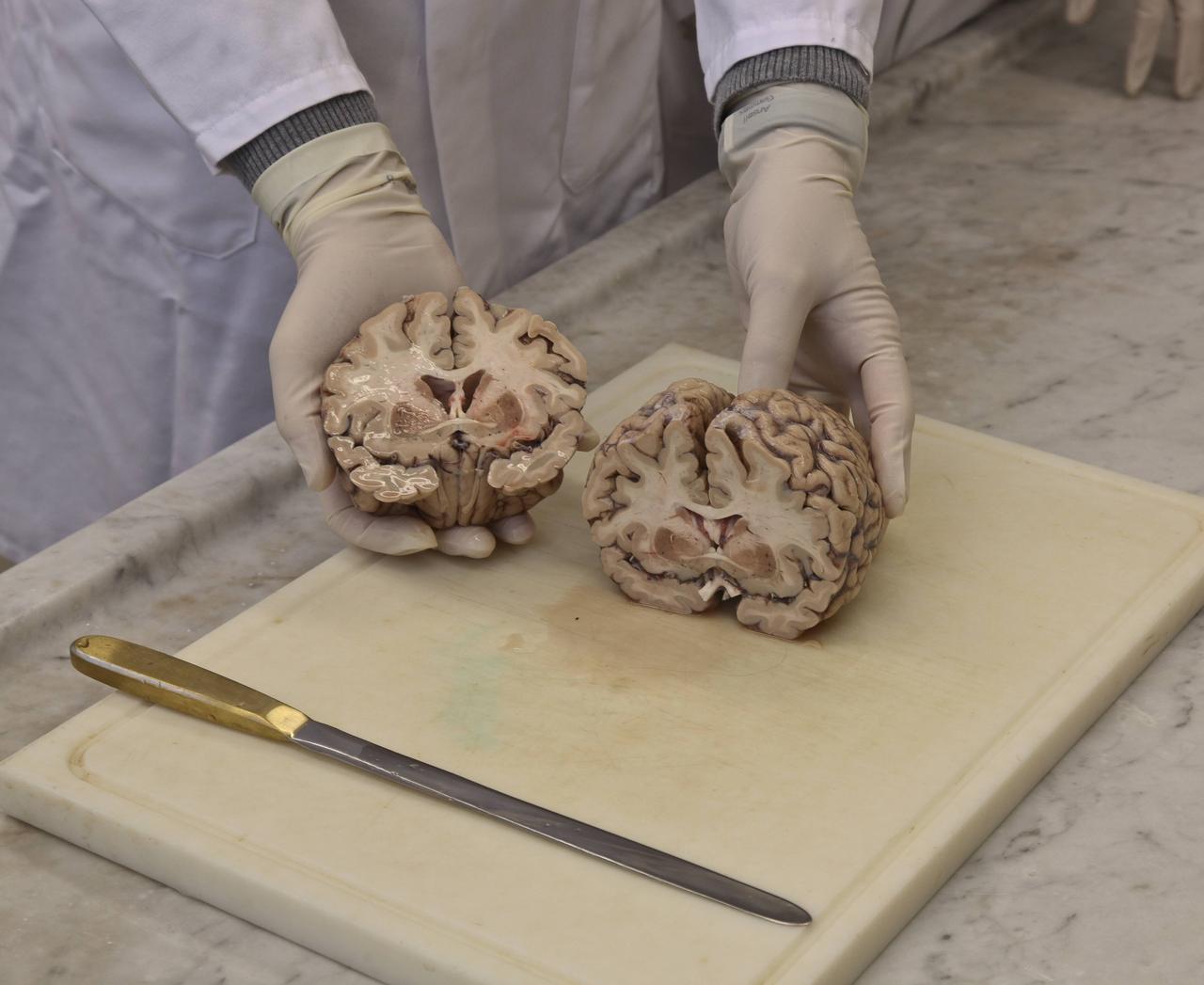
Antikörper markieren Amyloid-Ablagerungen
Lecanemab und Aducanumab arbeiten mit Antikörpern, Molekülen aus dem Arsenal unseres Immunsystems. Sie greifen ein Eiweiß an, das sich bei Alzheimer-Patienten im Gehirn ablagert. Das sogenannte Amyloid. Diese Ablagerungen sehen viele Wissenschaftler am Beginn einer Kaskade, die die Gedächtniserkrankung verursachen soll.
Die Antikörper markieren das Amyloid im Gehirn der Betroffenen, das Immunsystem kann es dann leichter abräumen. Eine ganze Reihe von Firmen haben dieses Prinzip ausprobiert. Viele Wirkstoffe beseitigen das Amyloid auch sehr effektiv. In regelmäßigen Untersuchungen des Gehirns der Studienprobanden ist das gut erkennbar. Doch auf den fortschreitenden Gedächtnisverlust zeigten die Medikamente in Studien bislang kaum Einfluss. Die meisten Studien wurden abgebrochen.
Seit knapp 20 Jahren wartet die Alzheimer-Forschung nun schon auf die Marktzulassung eines wirksamen Medikaments. Mit jeder gescheiterten Studie wachsen die Zweifel: Sind die Eiweißablagerungen wirklich der richtige Angriffspunkt?
Christian Behl forscht an der Universität Mainz zu Erkrankungen, die mit Nervenzelluntergang einhergehen, sogenannte neurodegenerative Erkrankungen. Auch Alzheimer gehört dazu. Er gehört zu den Zweiflern: „Ist es das wirklich? Ist das Amyloid der Killer, der verantwortlich ist für Alzheimer? Reicht es, Amyloid zu verhindern? Oder passiert da vielleicht vorher was ganz anderes?“
Die Antikörper markieren das Amyloid im Gehirn der Betroffenen, das Immunsystem kann es dann leichter abräumen. Eine ganze Reihe von Firmen haben dieses Prinzip ausprobiert. Viele Wirkstoffe beseitigen das Amyloid auch sehr effektiv. In regelmäßigen Untersuchungen des Gehirns der Studienprobanden ist das gut erkennbar. Doch auf den fortschreitenden Gedächtnisverlust zeigten die Medikamente in Studien bislang kaum Einfluss. Die meisten Studien wurden abgebrochen.
Seit knapp 20 Jahren wartet die Alzheimer-Forschung nun schon auf die Marktzulassung eines wirksamen Medikaments. Mit jeder gescheiterten Studie wachsen die Zweifel: Sind die Eiweißablagerungen wirklich der richtige Angriffspunkt?
Christian Behl forscht an der Universität Mainz zu Erkrankungen, die mit Nervenzelluntergang einhergehen, sogenannte neurodegenerative Erkrankungen. Auch Alzheimer gehört dazu. Er gehört zu den Zweiflern: „Ist es das wirklich? Ist das Amyloid der Killer, der verantwortlich ist für Alzheimer? Reicht es, Amyloid zu verhindern? Oder passiert da vielleicht vorher was ganz anderes?“
Hoch umstrittene Entscheidung der US-Zulassungsbehörde
Umso überraschter war er, als die US-amerikanische Arzneizulassungsbehörde FDA Aducanumab grünes Licht gab. Denn auch Aducanumab hat bis heute in Studien keinen eindeutigen Effekt auf die Gedächtnisleistung der Alzheimer-Patienten gezeigt.
„Ich hab mich gewundert, dass die Zulassung erfolgt ist. Denn letztendlich ist dieses Medikament eher eine Hoffnung als ein erwiesenermaßen erfolgreiches Medikament. Es ist eigentlich eher: Man hofft, dass, weil es eben so stark Amyloid abräumt - und das tut es ohne Zweifel -, dass es eben dann auch hilft.“
Die Zulassung von Aducanumab, das unter dem Namen Aduhelm nun in den USA verkauft wird, ist hoch umstritten. 2019 hatte der Hersteller Biogen mangels Erfolg zwei großangelegte Zulassungsstudien zu Aducanumab vorzeitig abgebrochen. Erst eine nachträgliche Auswertung ergab: Patienten, die eine besonders hohe Dosis erhielten, könnten vielleicht doch profitieren. Der Hersteller beantragte daraufhin die Zulassung bei der FDA.
Doch da die Studien nie zu Ende geführt wurden, ist die Datenlage schwierig. Ein Beratergremium der FDA sah keinen Beweis für eine Wirksamkeit der Substanz gegen den Gedächtnisverlust bei Alzheimer-Betroffenen. Christian Behl: „Und dass dann die FDA trotzdem sagt: Okay, danke für euren Rat, wir lassen es trotzdem zu. Das war etwas schwierig nachzuvollziehen.“
„Ich hab mich gewundert, dass die Zulassung erfolgt ist. Denn letztendlich ist dieses Medikament eher eine Hoffnung als ein erwiesenermaßen erfolgreiches Medikament. Es ist eigentlich eher: Man hofft, dass, weil es eben so stark Amyloid abräumt - und das tut es ohne Zweifel -, dass es eben dann auch hilft.“
Die Zulassung von Aducanumab, das unter dem Namen Aduhelm nun in den USA verkauft wird, ist hoch umstritten. 2019 hatte der Hersteller Biogen mangels Erfolg zwei großangelegte Zulassungsstudien zu Aducanumab vorzeitig abgebrochen. Erst eine nachträgliche Auswertung ergab: Patienten, die eine besonders hohe Dosis erhielten, könnten vielleicht doch profitieren. Der Hersteller beantragte daraufhin die Zulassung bei der FDA.
Doch da die Studien nie zu Ende geführt wurden, ist die Datenlage schwierig. Ein Beratergremium der FDA sah keinen Beweis für eine Wirksamkeit der Substanz gegen den Gedächtnisverlust bei Alzheimer-Betroffenen. Christian Behl: „Und dass dann die FDA trotzdem sagt: Okay, danke für euren Rat, wir lassen es trotzdem zu. Das war etwas schwierig nachzuvollziehen.“
Aducanumab verringert Amyloid - aber hilft es dem Gedächtnis?
Die FDA wählte einen besonderen Weg, die sogenannte beschleunigte Zulassung. Sie schaut hier mehr auf Studienparameter, die mit den Ursachen der Erkrankung in Zusammenhang stehen könnten. Bei Alzheimer sind das die Amyloid-Eiweiß-Ablagerungen im Gehirn. Sie setzt damit darauf, dass die Amyloid-Kaskaden-Hypothese als gängiges Erklärungsmodell zur Entstehung der Alzheimer-Erkrankung zutrifft.
„Wenn ein Medikament einen Erfolg haben soll, dann muss es eine Erkrankung heilen. Dem Kliniker ist es völlig egal, ob Amyloid da oder weg ist. Wenn man einen Antrag stellt, wir wollen ein Medikament zulassen, das Amyloid im Gehirn verringert, dann ist Aducanumab offensichtlich perfekt. Aber wenn man ein Medikament zulassen will, das den Alzheimer Patienten bei ihrer Gedächtnisleistung, ihrer kognitiven Leistung hilft, dann ist das letzte Wort noch nicht gesprochen.“
Nicht nur Christian Behl ist irritiert. Die ganze Alzheimer-Forschung durchzieht ein Graben entlang der Amyloid-Kaskaden-Hypothese. Und die US-Zulassung von Aducanumab hat diesen Graben noch einmal vertieft.
Doch wie kam es dazu? Warum spielt Amyloid heute die Hauptrolle bei der Suche nach einem Mittel im Kampf gegen die Alzheimer-Demenz?
„Wenn ein Medikament einen Erfolg haben soll, dann muss es eine Erkrankung heilen. Dem Kliniker ist es völlig egal, ob Amyloid da oder weg ist. Wenn man einen Antrag stellt, wir wollen ein Medikament zulassen, das Amyloid im Gehirn verringert, dann ist Aducanumab offensichtlich perfekt. Aber wenn man ein Medikament zulassen will, das den Alzheimer Patienten bei ihrer Gedächtnisleistung, ihrer kognitiven Leistung hilft, dann ist das letzte Wort noch nicht gesprochen.“
Nicht nur Christian Behl ist irritiert. Die ganze Alzheimer-Forschung durchzieht ein Graben entlang der Amyloid-Kaskaden-Hypothese. Und die US-Zulassung von Aducanumab hat diesen Graben noch einmal vertieft.
Doch wie kam es dazu? Warum spielt Amyloid heute die Hauptrolle bei der Suche nach einem Mittel im Kampf gegen die Alzheimer-Demenz?

Auffällige Ablagerungen im Hirn einer früh Verstorbenen
1901, Städtische Anstalt für Irre und Epileptische in Frankfurt am Main. Auguste Deter ist gerade erst in die Anstalt gekommen. Ihr Ehemann hat sie hergebracht. Sie habe sich im vergangenen Jahr stark verändert. Sie sei eifersüchtig geworden, könne einfache Aufgaben nicht mehr verrichten, verstecke Gegenstände und behellige aufdringlich die Nachbarschaft. Ein junger Assistenzarzt nimmt sie auf. Sein Name: Alois Alzheimer.
„Wie heißen Sie?“ „Auguste.“ „Familienname?“ „Auguste.“ „Wie heißt Ihr Mann?“ Auguste Deter zögert, antwortet schließlich: „Ich glaube... Auguste.“ „Sind Sie verheiratet?“ „Ach, ich bin doch so verwirrt.“
Es ist nicht das erste Mal, dass Alois Alzheimer eine schwer verwirrte Patientin aufnimmt. Doch die meisten sind 70 Jahre oder älter. Auguste Deter ist hingegen erst 51 Jahre alt.
Alois Alzheimer arbeitet nicht nur als Psychiater mit den Patienten, er sucht nach ihrem Tod auch in Gehirnschnitten nach Auffälligkeiten. Als er 1906 hört, dass seine ehemalige Patientin Auguste Deter verstorben ist, lässt er sich ihr Gehirn an seinen neuen Wirkungsort, nach München senden.
„Über die ganze Rinde zerstreut, besonders zahlreich in den oberen Schichten, findet man miliare Herdchen, welche durch Einlagerung eines eigenartigen Stoffes in die Hirnrinde bedingt sind. Er läßt sich schon ohne Färbung erkennen, ist aber Färbungen gegenüber sehr refraktär.“
„Wie heißen Sie?“ „Auguste.“ „Familienname?“ „Auguste.“ „Wie heißt Ihr Mann?“ Auguste Deter zögert, antwortet schließlich: „Ich glaube... Auguste.“ „Sind Sie verheiratet?“ „Ach, ich bin doch so verwirrt.“
Es ist nicht das erste Mal, dass Alois Alzheimer eine schwer verwirrte Patientin aufnimmt. Doch die meisten sind 70 Jahre oder älter. Auguste Deter ist hingegen erst 51 Jahre alt.
Alois Alzheimer arbeitet nicht nur als Psychiater mit den Patienten, er sucht nach ihrem Tod auch in Gehirnschnitten nach Auffälligkeiten. Als er 1906 hört, dass seine ehemalige Patientin Auguste Deter verstorben ist, lässt er sich ihr Gehirn an seinen neuen Wirkungsort, nach München senden.
„Über die ganze Rinde zerstreut, besonders zahlreich in den oberen Schichten, findet man miliare Herdchen, welche durch Einlagerung eines eigenartigen Stoffes in die Hirnrinde bedingt sind. Er läßt sich schon ohne Färbung erkennen, ist aber Färbungen gegenüber sehr refraktär.“
Diagnose von Alzheimer nach den Standards des Entdeckers
Der eigenartige Stoff ist Amyloid. Amyloide sind nicht die einzigen Ablagerungen, die Alois Alzheimer beschreibt. Doch sie dominieren bis heute die Ursachenforschung, und wie die Alzheimer-Erkrankung von anderen Demenzformen abgegrenzt wird.
"Wäre Alzheimer kein Pathologe gewesen, sondern vielleicht ein reiner Neurologe ohne pathologischen Background - er hätte diese Erkrankung ganz anders definiert und dann hätten wir vielleicht ganz andere Sachen geforscht."
Demenzerkrankungen unterscheiden sich in ihren Symptomen. Der fortschreitende Gedächtnisverlust ist für alle charakteristisch. Doch bei manchen stehen schon früh Veränderungen der Persönlichkeit im Vordergrund. Oder Halluzinationen. Die Alzheimer-Erkrankung zeichnet vor allem aus, dass die Gedächtnislücken in einer bestimmten Abfolge voranschreiten. Erst sind die Erinnerungen an kürzlich stattgefundene Ereignisse gestört. An weiter zurückliegende Erlebnisse, zum Beispiel aus ihrer Kindheit, können sich die Betroffenen hingegen noch lange erinnern. Im weiteren Krankheitsverlauf treten Schwierigkeiten mit Sprache und Motorik auf.
Psychiater können anhand der unterschiedlichen Ausprägungen die Demenzformen voneinander unterscheiden. Letzte Sicherheit gibt aber erst eine bildgebende Untersuchung auf Amyloid im Gehirn oder eine Untersuchung auf Bruchstücke in der Nervenflüssigkeit der Patienten. Zusammen mit einer weiteren Auffälligkeit in den Nervenzellen, den sogenannten Tau-Fibrillen, bestätigen diese Merkmale eine Alzheimer-Diagnose. Christian Behl:
"Also in der Definition, in der Diagnose der Erkrankung gilt nach wie vor letztlich der Standard, den der Alois Alzheimer gesetzt hat. Das Auftreten von Plaques und fibrillary Tangles, Tau-Ablagerungen. Diese beiden Merkmale müssen so vorkommen. Dann spricht man eindeutig von der Alzheimer-Erkrankung."
"Wäre Alzheimer kein Pathologe gewesen, sondern vielleicht ein reiner Neurologe ohne pathologischen Background - er hätte diese Erkrankung ganz anders definiert und dann hätten wir vielleicht ganz andere Sachen geforscht."
Demenzerkrankungen unterscheiden sich in ihren Symptomen. Der fortschreitende Gedächtnisverlust ist für alle charakteristisch. Doch bei manchen stehen schon früh Veränderungen der Persönlichkeit im Vordergrund. Oder Halluzinationen. Die Alzheimer-Erkrankung zeichnet vor allem aus, dass die Gedächtnislücken in einer bestimmten Abfolge voranschreiten. Erst sind die Erinnerungen an kürzlich stattgefundene Ereignisse gestört. An weiter zurückliegende Erlebnisse, zum Beispiel aus ihrer Kindheit, können sich die Betroffenen hingegen noch lange erinnern. Im weiteren Krankheitsverlauf treten Schwierigkeiten mit Sprache und Motorik auf.
Psychiater können anhand der unterschiedlichen Ausprägungen die Demenzformen voneinander unterscheiden. Letzte Sicherheit gibt aber erst eine bildgebende Untersuchung auf Amyloid im Gehirn oder eine Untersuchung auf Bruchstücke in der Nervenflüssigkeit der Patienten. Zusammen mit einer weiteren Auffälligkeit in den Nervenzellen, den sogenannten Tau-Fibrillen, bestätigen diese Merkmale eine Alzheimer-Diagnose. Christian Behl:
"Also in der Definition, in der Diagnose der Erkrankung gilt nach wie vor letztlich der Standard, den der Alois Alzheimer gesetzt hat. Das Auftreten von Plaques und fibrillary Tangles, Tau-Ablagerungen. Diese beiden Merkmale müssen so vorkommen. Dann spricht man eindeutig von der Alzheimer-Erkrankung."
PET - ein hilfreiches, aber teures bildgebendes Verfahren
In der Gedächtnisambulanz der Technischen Universität München wartet Jürgen Winter darauf, dass seine Infusion durchläuft. Als ehemaliger Programmierer weiß er nicht viel darüber, wie Alzheimer entsteht. Vom Amyloid-Eiweiß hat er aber schon gehört. „Ich weiß nur, dass es sich da um eine Ablagerung handelt und dass man das schwer stoppen kann und so weiter.“
Ob Lecanemab auch wirklich seinen Angriffspunkt findet, wird mit bildgebenden Verfahren überprüft. Timo Grimmer beaufsichtigt die Medikamentenstudie. Jetzt sucht er in seinen Unterlagen. Nur wenige Alzheimer-Patienten bekommen heute so ein genaues Bild ihrer Ablagerungen.
„…zögern sie sehr, sag ich jetzt mal sehr vorsichtig; und auch zum Beispiel Amyloid-PET ist eine Geschichte, die von den Krankenkassen nicht so leicht erstattet wird. Das ist immer ein Einzelfallantrag mit der Krankenversicherung tatsächlich. Obwohl es eine sehr hilfreiche Untersuchung ist, ist sie auch auf der anderen Seite leider eine nicht billige Untersuchung. Und sodass natürlich immer eine Abwägung in unserem Gesundheitssystem vorgenommen wird - was ist halt noch zu bezahlen?“
Bei der Positronen-Emissions-Tomographie, kurz PET, werden die Patienten – ähnlich wie bei einem MRT oder CT - in eine Röhre gelegt. Die Untersuchung ist nur deutlich teurer. „Also die PET-Diagnostik ist eine sogenannte Schichtbild-Diagnostik. Das heißt, so wie man das von Computertomografien, Kernspintomografien kennt, werden Bilder erhoben, indem man so tut, als ob man das Gehirn in Scheiben schneidet.“
Ob Lecanemab auch wirklich seinen Angriffspunkt findet, wird mit bildgebenden Verfahren überprüft. Timo Grimmer beaufsichtigt die Medikamentenstudie. Jetzt sucht er in seinen Unterlagen. Nur wenige Alzheimer-Patienten bekommen heute so ein genaues Bild ihrer Ablagerungen.
„…zögern sie sehr, sag ich jetzt mal sehr vorsichtig; und auch zum Beispiel Amyloid-PET ist eine Geschichte, die von den Krankenkassen nicht so leicht erstattet wird. Das ist immer ein Einzelfallantrag mit der Krankenversicherung tatsächlich. Obwohl es eine sehr hilfreiche Untersuchung ist, ist sie auch auf der anderen Seite leider eine nicht billige Untersuchung. Und sodass natürlich immer eine Abwägung in unserem Gesundheitssystem vorgenommen wird - was ist halt noch zu bezahlen?“
Bei der Positronen-Emissions-Tomographie, kurz PET, werden die Patienten – ähnlich wie bei einem MRT oder CT - in eine Röhre gelegt. Die Untersuchung ist nur deutlich teurer. „Also die PET-Diagnostik ist eine sogenannte Schichtbild-Diagnostik. Das heißt, so wie man das von Computertomografien, Kernspintomografien kennt, werden Bilder erhoben, indem man so tut, als ob man das Gehirn in Scheiben schneidet.“
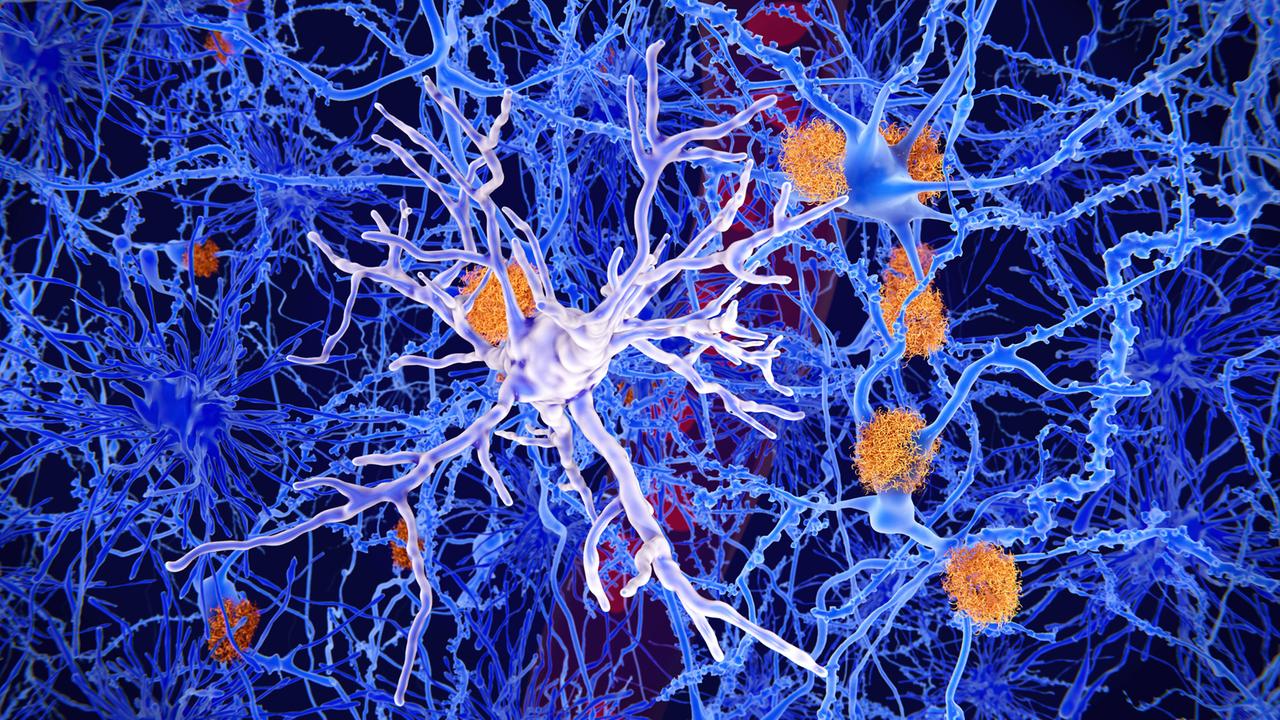
Gelbe und rote Farbtöne bedeuten: Amyloid-Ablagerungen
Die Patienten nehmen radioaktive Substanzen ein, die sehr spezifisch das Amyloid sichtbar machen. Die Untersuchung führen Nuklearmediziner durch. Psychiater wie Timo Grimmer bekommen das fertig befundete Bild. Anders als schwarz-weiße Röntgen- oder MRT-Bilder leuchtet das PET-Bild nur so vor Farben. „… tatsächlich jetzt einfach noch einen Vergleich. Da hab ich vorhin die Ordner durchgeblättert und bin fast verzweifelt…“
Im gesunden Gehirn dominieren grüne und blaue Farbtöne. Ganz anders bei Alzheimer-Betroffenen: „Also je wärmere Farben, desto höhere Signal-Dichte. Überall da, wo man jetzt im Bereich der Hirnrinde diese gelb-roten Farben sieht, und sie sehen, das ist glaube ich nicht schwer zu erkennen, dass das Hirn hier auf allen Schichten durchgehend voll zu sein scheint. Das sind die spezifischen Amyloid-Ablagerungen."
Es wirkt wie ein Warnzeichen: Vorsicht, hier ist Amyloid.
Nachdem Alois Alzheimer 1906 die Ablagerungen beschrieben hat, bleiben sie lange Zeit nur eine Beobachtung in Hirnschnitten verstorbener Patienten. 1984 dann werden die Plaques erstmals isoliert und analysiert, 1986 die genetische Sequenz von Amyloid-ß entschlüsselt. Langsam beginnen die Forscher zu verstehen, woher die Ablagerungen kommen.
Sie entstehen aus einem Eiweiß, das sich in den Zellmembranen der Nervenzellen befindet, das sogenannte Amyloid-Vorläuferprotein. Immer wieder wird es durch andere Eiweiße, sogenannte Enzyme, an der Zelloberfläche zerschnitten. Die Bruchstücke, das sogenannte Amyloid-ß, lagert sich außerhalb der Zelle in deutlich sichtbaren Plaques ab.
Im gesunden Gehirn dominieren grüne und blaue Farbtöne. Ganz anders bei Alzheimer-Betroffenen: „Also je wärmere Farben, desto höhere Signal-Dichte. Überall da, wo man jetzt im Bereich der Hirnrinde diese gelb-roten Farben sieht, und sie sehen, das ist glaube ich nicht schwer zu erkennen, dass das Hirn hier auf allen Schichten durchgehend voll zu sein scheint. Das sind die spezifischen Amyloid-Ablagerungen."
Es wirkt wie ein Warnzeichen: Vorsicht, hier ist Amyloid.
Nachdem Alois Alzheimer 1906 die Ablagerungen beschrieben hat, bleiben sie lange Zeit nur eine Beobachtung in Hirnschnitten verstorbener Patienten. 1984 dann werden die Plaques erstmals isoliert und analysiert, 1986 die genetische Sequenz von Amyloid-ß entschlüsselt. Langsam beginnen die Forscher zu verstehen, woher die Ablagerungen kommen.
Sie entstehen aus einem Eiweiß, das sich in den Zellmembranen der Nervenzellen befindet, das sogenannte Amyloid-Vorläuferprotein. Immer wieder wird es durch andere Eiweiße, sogenannte Enzyme, an der Zelloberfläche zerschnitten. Die Bruchstücke, das sogenannte Amyloid-ß, lagert sich außerhalb der Zelle in deutlich sichtbaren Plaques ab.

Auch normale, gesunde Zellen produzieren Amyloid
In München am Deutschen Zentrum für Neurodegenerative Erkrankungen forscht Christian Haass an den biologischen Mechanismen, die sich in Gehirnzellen von Alzheimer-Betroffenen abspielen. Ende der 1980er-Jahre, als die Mechanismen hinter den Ablagerungen entschlüsselt werden, ist er gerade mit seinem Biologie-Studium fertig. Warum genau das Amyloid-Vorläuferprotein zerschnitten wird und die Ablagerungen nicht beseitigt werden, ist damals nicht bekannt. Nach seiner Doktorarbeit wechselt Christian Haass Anfang der 1990er-Jahre nach Amerika, um in Harvard an Amyloid zu forschen. Die meisten Wissenschaftler gehen zu diesem Zeitpunkt davon aus, dass Amyloid nur bei Alzheimer-Patienten vorkommt.
„Und als junger Postdoktorand kann man durchaus mal frech sein und richtig freche Fragen stellen. Und das habe ich damals im Lab-Meeting getan. Und habe nur gefragt: Woher wisst ihr das eigentlich? Ist es so, dass Alzheimer-Patienten ausschließlich dieses Amyloid machen? Hat denn je jemand überhaupt nachgewiesen, dass es irgendwo in Zellen überhaupt hergestellt wird? Gibt es irgendwelche Daten dazu? Hat das überhaupt jemand angeguckt? Da hat man mich ganz groß angeguckt und gesagt: Ne, das wird einfach angenommen, aber ist doch logisch. Das muss man sich ja gar nicht angucken.“
Christian Haass geht ins Labor. Er sieht sich Zellen von gesunden Menschen an und erkennt: Sie alle produzieren Amyloid. "Ich weiß noch genau den Tag und Stunde, die Minute, wo das stattgefunden hat. Wo ich in der Dunkelkammer stand und zum ersten Mal einen Film entwickelt habe, das Amyloid sichtbar war und produziert aus einer normalen, gesunden Zelle.“
Christian Haass zeigt seinem Chef seine Entdeckung. Sie machen weitere Experimente. Untersuchen ihre eigenen Blutzellen. Auch hier wird Amyloid produziert, überall im Körper, nicht nur im Gehirn.
„Und als junger Postdoktorand kann man durchaus mal frech sein und richtig freche Fragen stellen. Und das habe ich damals im Lab-Meeting getan. Und habe nur gefragt: Woher wisst ihr das eigentlich? Ist es so, dass Alzheimer-Patienten ausschließlich dieses Amyloid machen? Hat denn je jemand überhaupt nachgewiesen, dass es irgendwo in Zellen überhaupt hergestellt wird? Gibt es irgendwelche Daten dazu? Hat das überhaupt jemand angeguckt? Da hat man mich ganz groß angeguckt und gesagt: Ne, das wird einfach angenommen, aber ist doch logisch. Das muss man sich ja gar nicht angucken.“
Christian Haass geht ins Labor. Er sieht sich Zellen von gesunden Menschen an und erkennt: Sie alle produzieren Amyloid. "Ich weiß noch genau den Tag und Stunde, die Minute, wo das stattgefunden hat. Wo ich in der Dunkelkammer stand und zum ersten Mal einen Film entwickelt habe, das Amyloid sichtbar war und produziert aus einer normalen, gesunden Zelle.“
Christian Haass zeigt seinem Chef seine Entdeckung. Sie machen weitere Experimente. Untersuchen ihre eigenen Blutzellen. Auch hier wird Amyloid produziert, überall im Körper, nicht nur im Gehirn.
Hohe Problem-Chance in Nervenzellen und im Gehirn
Seine Entdeckung legt den Grundstein für die spätere Entwicklung von Anti-Amyloid-Therapien. „Erst mal hat man damit schlagartig über Nacht ein Zellkultursystem, wie es einfacher nicht ist, in der Hand gehabt, um die Produktion zu studieren und auch Medikamente zu finden, die das wiederum verhindern. Und gleichzeitig konnte man dieses System auch verwenden, um nach Medikamenten zu suchen. Die Medikamente, die die Produktion reduzieren. Es war ein Riesen-Durchbruch gewesen, damals, der über Nacht auch das gesamte Arbeitsgebiet letztendlich auf den Kopf gestellt hat.“
Doch wenn Amyloid im gesamten Körper produziert wird, warum wird es dann gerade bei Alzheimer-Patienten zu einem Problem? Christian Haass: „Der Grund ist ein ganz einfacher: Solche Gene, die werden unterschiedlich stark abgeschrieben in verschiedenen Zelltypen. Und ausgerechnet dieses Gen, was dieses Amyloid kodiert, wird extrem stark, also super, extrem stark in Nervenzellen abgeschrieben und dort mit Abstand am meisten gemacht. Es ist eines der häufigsten Proteine in den Nervenzellen überhaupt. Und damit ist natürlich die Chance, dass im Gehirn was passiert, drastisch höher.“
Die Entstehung von Amyloid ist nicht der einzige zellbiologische Vorgang, den Forscher damals untersuchen, um mehr über die Ursachen der Alzheimer-Erkrankung zu erfahren. Auch die Tau-Fibrillen sollen eine Rolle spielen. Und auch Entzündungen im Gehirn von Alzheimer-Betroffenen wecken Forschungsinteressen. Doch die verschiedenen Erklärungsansätze werden entweder in die Amyloid-Kaskaden-Hypothese integriert oder nur von wenigen Wissenschaftlern verfolgt.
Doch wenn Amyloid im gesamten Körper produziert wird, warum wird es dann gerade bei Alzheimer-Patienten zu einem Problem? Christian Haass: „Der Grund ist ein ganz einfacher: Solche Gene, die werden unterschiedlich stark abgeschrieben in verschiedenen Zelltypen. Und ausgerechnet dieses Gen, was dieses Amyloid kodiert, wird extrem stark, also super, extrem stark in Nervenzellen abgeschrieben und dort mit Abstand am meisten gemacht. Es ist eines der häufigsten Proteine in den Nervenzellen überhaupt. Und damit ist natürlich die Chance, dass im Gehirn was passiert, drastisch höher.“
Die Entstehung von Amyloid ist nicht der einzige zellbiologische Vorgang, den Forscher damals untersuchen, um mehr über die Ursachen der Alzheimer-Erkrankung zu erfahren. Auch die Tau-Fibrillen sollen eine Rolle spielen. Und auch Entzündungen im Gehirn von Alzheimer-Betroffenen wecken Forschungsinteressen. Doch die verschiedenen Erklärungsansätze werden entweder in die Amyloid-Kaskaden-Hypothese integriert oder nur von wenigen Wissenschaftlern verfolgt.
Genetik spricht für Amyloid-Kaskaden-Hypothese
Denn es gibt gute Gründe, Amyloid am Beginn der Kaskade zu sehen, sagt Christian Haass. „Argumente für die Amyloid-Kaskade sind meiner Meinung nach ganz klar zuallererst die Genetik! Wir wussten bereits seit 1988, dass das Gen, das das Amyloid kodiert, auf Chromosom 21 liegt und jeder weiß, was bei einer Trisomie 21 passiert. Die Patienten entwickeln Down-Syndrom. Was die meisten nicht wissen ist, dass die Patienten im Alter von 50 etwa einen verfrühten Alzheimer obendrauf bekommen.“
Offensichtlich führt die zusätzliche Kopie des Amyloid-Gens zu einer genetisch bedingten Alzheimer-Erkrankung bei Down-Syndrom-Betroffenen. Auch ohne Trisomie 21 erkranken manche Menschen schon weit vor dem sechzigsten Lebensjahr an einer Alzheimer-Demenz. Diese seltenen Fälle sind vererbt. Erkrankt ein Elternteil an dieser frühen Form von Alzheimer, sind auch die Kinder in der Hälfte der Fälle betroffen. Schon Anfang der 1990er-Jahre identifizieren Forscher die Veränderungen im Erbgut, die für die Erkrankung verantwortlich sind.
Christian Haass: „All diese Mutationen machen ein und dasselbe. Sie erhöhen entweder die Produktion, die totale Menge des Amyloids oder sie machen ein längeres Amyloid und es verklebt schneller. Es bildet schneller die Plaques. Und das ist für alle diese Gene gleich!“
Offensichtlich führt die zusätzliche Kopie des Amyloid-Gens zu einer genetisch bedingten Alzheimer-Erkrankung bei Down-Syndrom-Betroffenen. Auch ohne Trisomie 21 erkranken manche Menschen schon weit vor dem sechzigsten Lebensjahr an einer Alzheimer-Demenz. Diese seltenen Fälle sind vererbt. Erkrankt ein Elternteil an dieser frühen Form von Alzheimer, sind auch die Kinder in der Hälfte der Fälle betroffen. Schon Anfang der 1990er-Jahre identifizieren Forscher die Veränderungen im Erbgut, die für die Erkrankung verantwortlich sind.
Christian Haass: „All diese Mutationen machen ein und dasselbe. Sie erhöhen entweder die Produktion, die totale Menge des Amyloids oder sie machen ein längeres Amyloid und es verklebt schneller. Es bildet schneller die Plaques. Und das ist für alle diese Gene gleich!“
Familien mit Genveränderung bleiben demenzfrei
Christian Behl überzeugt allein dieses Argument noch nicht: "Denn eins darf man nicht vergessen: Alzheimer ist eine Alters-Erkrankung. Und diese vorhin genannten familiären Formen machen nur minimale Prozent-Anteile an allen Alzheimer-Patienten aus."
Von den familiären Formen auf die sogenannten sporadischen Formen der Erkrankung zu schließen, hält er für zu einfach. „Es könnten zwei verschiedene Krankheitsbilder sein. Es könnte eine Einheit geben, die Amyloid-abhängig ist. Möglicherweise ja. Und die sporadischen Fälle, die könnten sich auch noch mal unterteilen.“
Doch auch bei den sporadischen Formen gibt es aus Sicht von Christian Haass gute Gründe anzunehmen, dass Amyloid eine entscheidende Rolle bei der Entstehung der Erkrankung spielt. „Man hat natürlich auch geguckt, ob es Fälle gibt, die gar kein Alzheimer kriegen, also das genaue Gegenteil. Und die hat man tatsächlich auch gefunden. Es gibt eine Familie auf Island, die über Generationen hinweg, sind die bis zu hundert Jahre alt geworden oder auch darüber und haben keine Demenz entwickelt."
Eine ähnliche Familie wurde kurze Zeit später auch in Finnland entdeckt. Die Analyse des Erbguts der beiden Familien zeigt: Beide haben eine Veränderung in einer Gensequenz, die für die Amyloid-Entstehung wichtig ist.
„Und was macht diese Genveränderung? Die reduziert die Produktion übers Leben hinweg um ganze 20 bis 30 Prozent, also relativ wenig. Aber es geht über das Leben hinweg. Das heißt wir machen weniger Amyloid, dann kriegen wir die Krankheit nicht. Und das heißt, die Evolution hat uns hier eigentlich eine Art Feldversuch vorgeführt, wie man Alzheimer behandelt."
Von den familiären Formen auf die sogenannten sporadischen Formen der Erkrankung zu schließen, hält er für zu einfach. „Es könnten zwei verschiedene Krankheitsbilder sein. Es könnte eine Einheit geben, die Amyloid-abhängig ist. Möglicherweise ja. Und die sporadischen Fälle, die könnten sich auch noch mal unterteilen.“
Doch auch bei den sporadischen Formen gibt es aus Sicht von Christian Haass gute Gründe anzunehmen, dass Amyloid eine entscheidende Rolle bei der Entstehung der Erkrankung spielt. „Man hat natürlich auch geguckt, ob es Fälle gibt, die gar kein Alzheimer kriegen, also das genaue Gegenteil. Und die hat man tatsächlich auch gefunden. Es gibt eine Familie auf Island, die über Generationen hinweg, sind die bis zu hundert Jahre alt geworden oder auch darüber und haben keine Demenz entwickelt."
Eine ähnliche Familie wurde kurze Zeit später auch in Finnland entdeckt. Die Analyse des Erbguts der beiden Familien zeigt: Beide haben eine Veränderung in einer Gensequenz, die für die Amyloid-Entstehung wichtig ist.
„Und was macht diese Genveränderung? Die reduziert die Produktion übers Leben hinweg um ganze 20 bis 30 Prozent, also relativ wenig. Aber es geht über das Leben hinweg. Das heißt wir machen weniger Amyloid, dann kriegen wir die Krankheit nicht. Und das heißt, die Evolution hat uns hier eigentlich eine Art Feldversuch vorgeführt, wie man Alzheimer behandelt."
Maus-Modell weckt vorschnelle Impf-Hoffnungen
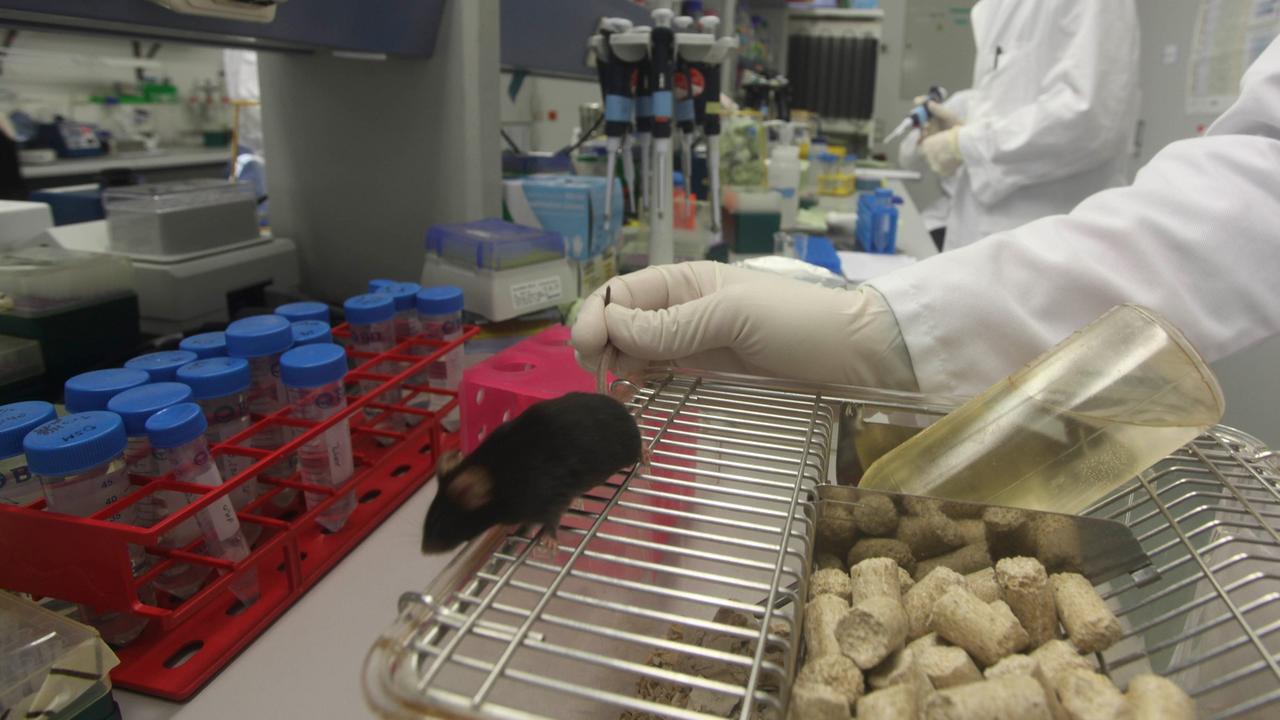
Auch die Medikamentenforschung konzentriert sich in den 1990er-Jahren darauf, ein Mittel gegen das Amyloid-Eiweiß zu finden. Forscher schaffen ein genetisch verändertes Mausmodell. Diese Mäuse produzieren Unmengen Amyloid in ihrem Gehirn. Ende der 1990er-Jahre gelingt es dem US-Amerikaner Dale Schenk, eine Impfung gegen Amyloid zu entwickeln. Die damit behandelten transgenen Mäuse bilden keine Ablagerungen mehr. Christian Haass erinnert sich:
„Das war ein fantastisches Ergebnis. Und es wurde damals auf einer Riesenkonferenz in Washington vorgestellt. Und die Wissenschaftler waren natürlich alle total überrascht und begeistert. Aber gleichzeitig war die Stimmung sehr merkwürdig. Viele von uns haben abends an der Bar dann gemunkelt: Na ja, jetzt gehen wir nach Hause und können in unseren Labors das Licht aus und die Tür zu machen oder uns ein anderes Arbeitsgebiet suchen. Und genau deswegen haben viele meiner Kollegen damals umgesattelt auf Parkinson-Forschung zu dem Zeitpunkt, weil sie dachten: Na ja, die Alzheimer-Forschung ist hiermit beendet.“
Der Neuroanatom Thomas Arendt ist heute Vorsitzender des wissenschaftlichen Beirats der Alzheimer-Forschungs-Initiative, ein privater Verein, der die Alzheimer-Forschung in Deutschland unterstützt. „Die Euphorie habe ich nie geteilt! Widerspricht ein bisschen meinem Weltbild, anzunehmen, dass so hohe komplexe Leistungen wie Lernen, Gedächtnis, Sprache sich durch die Regulation von einem einzelnen Molekül substanziell beeinflussen lassen.“
Die Experimente mit den transgenen Mäusen, an denen die Anti-Amyloid-Wirkstoffe erprobt worden sind, sah Arendt mit Skepsis: Denn die menschliche Alzheimer-Erkrankung sei deutlich komplexer als der Zustand der transgenen Mäuse. „Die sind ja kein Forschungsinstrument, um nach den Ursachen zu forschen, weil die auf einer definierten eingeführten Ursache, nämlich dem Transgenen natürlich beruhen und nur Folgen untersuchen können, aber keine Ursachen."
Tatsächlich müssen klinische Studien zur Impfung gegen Amyloid wegen schwerer Nebenwirkungen abgebrochen werden.
„Das war ein fantastisches Ergebnis. Und es wurde damals auf einer Riesenkonferenz in Washington vorgestellt. Und die Wissenschaftler waren natürlich alle total überrascht und begeistert. Aber gleichzeitig war die Stimmung sehr merkwürdig. Viele von uns haben abends an der Bar dann gemunkelt: Na ja, jetzt gehen wir nach Hause und können in unseren Labors das Licht aus und die Tür zu machen oder uns ein anderes Arbeitsgebiet suchen. Und genau deswegen haben viele meiner Kollegen damals umgesattelt auf Parkinson-Forschung zu dem Zeitpunkt, weil sie dachten: Na ja, die Alzheimer-Forschung ist hiermit beendet.“
Der Neuroanatom Thomas Arendt ist heute Vorsitzender des wissenschaftlichen Beirats der Alzheimer-Forschungs-Initiative, ein privater Verein, der die Alzheimer-Forschung in Deutschland unterstützt. „Die Euphorie habe ich nie geteilt! Widerspricht ein bisschen meinem Weltbild, anzunehmen, dass so hohe komplexe Leistungen wie Lernen, Gedächtnis, Sprache sich durch die Regulation von einem einzelnen Molekül substanziell beeinflussen lassen.“
Die Experimente mit den transgenen Mäusen, an denen die Anti-Amyloid-Wirkstoffe erprobt worden sind, sah Arendt mit Skepsis: Denn die menschliche Alzheimer-Erkrankung sei deutlich komplexer als der Zustand der transgenen Mäuse. „Die sind ja kein Forschungsinstrument, um nach den Ursachen zu forschen, weil die auf einer definierten eingeführten Ursache, nämlich dem Transgenen natürlich beruhen und nur Folgen untersuchen können, aber keine Ursachen."
Tatsächlich müssen klinische Studien zur Impfung gegen Amyloid wegen schwerer Nebenwirkungen abgebrochen werden.

Auch bei Antikörper-Präparaten Nebenwirkungen möglich
Mit den Antikörper-Präparaten wie dem nun durch die FDA zugelassenen Wirkstoff Aducanumab wird das Immunsystem auf anderem Wege angeregt, Amyloid zu entfernen. Sie sind besser verträglich als die ursprüngliche Impfung, aber immer noch nicht harmlos: Bei manchen Patienten kommt es etwa zu lokalen Hirnschwellungen und Mikroblutungen. Und den zweifelsfreien Beleg, dass sie auch die Gedächtnisleistung der Patienten verbessern, bleiben die Präparate bis heute schuldig.
Christian Haass gibt sich selbstkritisch: „Wir dürfen auf keinen Fall falsche Hoffnungen schüren. Das wäre das Schlimmste, was man machen kann. Und es wurde in meinem Arbeitsgebiet in den letzten 20 Jahren ständig gemacht, auch von uns Wissenschaftlern und auch von mir selbst leider.“
Doch schürt die FDA-Entscheidung zu Aducanumab nicht gerade das? Große Hoffnungen auf ein Medikament, dessen Nutzen für die Demenzpatienten hoch umstritten ist?
Nach einer Stunde ist Jürgen Winters Infusion durchgelaufen. Auch er hat mitbekommen, dass in den USA nun ein Medikament gegen Alzheimer zugelassen wurde, ganz ähnlich dem Medikament, das in seiner Studie untersucht wird. Was ging Jürgen Winter durch den Kopf, als er von der Zulassung hörte?
„Ja natürlich Hoffnung, klar, nicht? Ich muss wirklich sagen, das ist ja eine Krankheit, die es seit Jahrhunderten gibt. Und ich bin jetzt noch in der Zeit, wo man sagt: Okay, das kann mir noch helfen. Ich bin ja einer der ersten, bei dem das dann so ist. Das heißt, ich bin ja ein glücklicher Mensch. Eigentlich, nicht? Wenn ich jetzt 15 Jahre älter wäre, dann wäre das schon vorbei. Dann wäre ich wahrscheinlich jetzt schon dement und die Sache wäre aus für mich. Also insofern muss ich wirklich sagen, bin ich doch… kann ich nur sagen, habe ich Glück gehabt? Nicht?“
Christian Haass gibt sich selbstkritisch: „Wir dürfen auf keinen Fall falsche Hoffnungen schüren. Das wäre das Schlimmste, was man machen kann. Und es wurde in meinem Arbeitsgebiet in den letzten 20 Jahren ständig gemacht, auch von uns Wissenschaftlern und auch von mir selbst leider.“
Doch schürt die FDA-Entscheidung zu Aducanumab nicht gerade das? Große Hoffnungen auf ein Medikament, dessen Nutzen für die Demenzpatienten hoch umstritten ist?
Nach einer Stunde ist Jürgen Winters Infusion durchgelaufen. Auch er hat mitbekommen, dass in den USA nun ein Medikament gegen Alzheimer zugelassen wurde, ganz ähnlich dem Medikament, das in seiner Studie untersucht wird. Was ging Jürgen Winter durch den Kopf, als er von der Zulassung hörte?
„Ja natürlich Hoffnung, klar, nicht? Ich muss wirklich sagen, das ist ja eine Krankheit, die es seit Jahrhunderten gibt. Und ich bin jetzt noch in der Zeit, wo man sagt: Okay, das kann mir noch helfen. Ich bin ja einer der ersten, bei dem das dann so ist. Das heißt, ich bin ja ein glücklicher Mensch. Eigentlich, nicht? Wenn ich jetzt 15 Jahre älter wäre, dann wäre das schon vorbei. Dann wäre ich wahrscheinlich jetzt schon dement und die Sache wäre aus für mich. Also insofern muss ich wirklich sagen, bin ich doch… kann ich nur sagen, habe ich Glück gehabt? Nicht?“
EU-Arzneimittelagentur verweigert Aducanumab Zulassung
Im Dezember 2021 fällt auch diesseits des Atlantiks das Urteil. Monatelang hat die europäische Arzneimittelagentur beraten. Am Ende entscheidet sie anders als die FDA. Aducanumab wird in der EU nicht zugelassen. Christian Behl überrascht das nicht. „Aufgrund der Datenlage hatte die EMA aus meiner Sicht überhaupt keine andere Möglichkeit als die Zulassung zu verweigern.“
Und Christian Haass? „Ich möchte die Entscheidung nicht kritisieren. Da sitzen Fachleute in dem entsprechenden Rat, die wissen, was sie getan haben. Die haben das gut begründet. Ich würde es nur nicht als ein Zeichen dafür betrachten, dass die Immunisierung gegen Alzheimer nicht wirksam ist und nicht weiterverfolgt werden sollte. Das wäre ein fatales Signal.“
Nachgefragt wird Aducanumab in den USA kaum. Das staatliche Versicherungsprogramm Medicare hat angekündigt, die Kosten nur für Patienten im Rahmen klinischer Studien zu übernehmen. Christian Haass: „Ich glaube das wird das Feld sogar noch einmal anfeuern, um noch mehr Daten zu liefern, bessere Daten zu liefern; und es sind ja noch einige weitere klinische Versuche momentan unterwegs, die bereits recht hoffnungsvolle Daten haben, auch in Bezug auf Gedächtnisstabilisierung. Und die werden natürlich jetzt ganz und gar nicht aufgeben, sondern im Gegenteil sich richtig beeilen und versuchen, wirklich gute Daten letztendlich zu liefern.“
Und Christian Haass? „Ich möchte die Entscheidung nicht kritisieren. Da sitzen Fachleute in dem entsprechenden Rat, die wissen, was sie getan haben. Die haben das gut begründet. Ich würde es nur nicht als ein Zeichen dafür betrachten, dass die Immunisierung gegen Alzheimer nicht wirksam ist und nicht weiterverfolgt werden sollte. Das wäre ein fatales Signal.“
Nachgefragt wird Aducanumab in den USA kaum. Das staatliche Versicherungsprogramm Medicare hat angekündigt, die Kosten nur für Patienten im Rahmen klinischer Studien zu übernehmen. Christian Haass: „Ich glaube das wird das Feld sogar noch einmal anfeuern, um noch mehr Daten zu liefern, bessere Daten zu liefern; und es sind ja noch einige weitere klinische Versuche momentan unterwegs, die bereits recht hoffnungsvolle Daten haben, auch in Bezug auf Gedächtnisstabilisierung. Und die werden natürlich jetzt ganz und gar nicht aufgeben, sondern im Gegenteil sich richtig beeilen und versuchen, wirklich gute Daten letztendlich zu liefern.“
Effekte auf Gedächtnisleistung werden vermutlich minimal sein
Selbst wenn in den nächsten Jahren Studien wie die, an der Jürgen Winter teilnimmt, eine Wirkung von Antikörper-Präparaten auf die Gedächtnisfunktionen von Alzheimer-Patienten zeigen sollten, die Effekte werden wahrscheinlich minimal sein.
„Also man darf wirklich keine falschen Hoffnungen haben, auch wenn die jetzt wirken. Man wird wahrscheinlich als Patient selber kaum was spüren.“
Auch Christian Haass forscht heute überwiegend an einem anderen Ansatz. Er sieht sich die Entzündungen der Nervenzellen an, die bei Alzheimer auftreten. „Forschung funktioniert nur im Team. Und das ist ein globales Problem, an dem wir arbeiten. Das müssen wir gemeinsam lösen. Da können wir keinen außen vorlassen, auch keine andere Meinung.“
Christian Behl versucht mit einem neuen Netzwerk mehr Austausch zwischen den Fachdisziplinen anzuregen: „Die Amyloid-Hypothese zu kippen wäre größenwahnsinnig. Will ich auch gar nicht. Es gibt hervorragende Arbeiten dazu. Und dennoch bleibt es eine These. Und deshalb plädiere ich dafür, offen zu sein.“
„Also man darf wirklich keine falschen Hoffnungen haben, auch wenn die jetzt wirken. Man wird wahrscheinlich als Patient selber kaum was spüren.“
Auch Christian Haass forscht heute überwiegend an einem anderen Ansatz. Er sieht sich die Entzündungen der Nervenzellen an, die bei Alzheimer auftreten. „Forschung funktioniert nur im Team. Und das ist ein globales Problem, an dem wir arbeiten. Das müssen wir gemeinsam lösen. Da können wir keinen außen vorlassen, auch keine andere Meinung.“
Christian Behl versucht mit einem neuen Netzwerk mehr Austausch zwischen den Fachdisziplinen anzuregen: „Die Amyloid-Hypothese zu kippen wäre größenwahnsinnig. Will ich auch gar nicht. Es gibt hervorragende Arbeiten dazu. Und dennoch bleibt es eine These. Und deshalb plädiere ich dafür, offen zu sein.“
War die Amyloid-Fokussierung kontraproduktiv?
Die Alzheimer-Forschung wurde von der Amyloid-Hypothese lange Zeit dominiert. Bis heute gibt es gute Gründe anzunehmen, dass Amyloid eine wesentliche Rolle bei der Erkrankung spielt. Doch hätte sich die Medikamentenentwicklung nicht schon frühzeitig auf das Eiweiß als Zielmolekül fokussiert, vielleicht hätten wir heute mehr in der Hand als Antikörper-Präparate, die, wenn überhaupt, einen überschaubaren Effekt auf die Gedächtnisleistung von Alzheimer-Betroffenen zeigen.
Eine Heilung von Alzheimer, das wird es auf absehbare Zeit nicht geben. Ein großer Erfolg wäre es schon, Betroffene in einem gewissen Stadium ihrer Erkrankung zu stabilisieren.
Christian Haass: „Das ist mein großer Lebenstraum, dass wir so was mal erleben. Wir wollen nicht mehr, als einen Patienten, der in die Klinik kommt, an dem Stadium aufhalten, mit dem er in der Klinik auftaucht. Und das zu erreichen, da haben wir noch einen weiten Weg vor uns. Einen sehr, sehr weiten Weg.“
Eine Heilung von Alzheimer, das wird es auf absehbare Zeit nicht geben. Ein großer Erfolg wäre es schon, Betroffene in einem gewissen Stadium ihrer Erkrankung zu stabilisieren.
Christian Haass: „Das ist mein großer Lebenstraum, dass wir so was mal erleben. Wir wollen nicht mehr, als einen Patienten, der in die Klinik kommt, an dem Stadium aufhalten, mit dem er in der Klinik auftaucht. Und das zu erreichen, da haben wir noch einen weiten Weg vor uns. Einen sehr, sehr weiten Weg.“