Knapp eine Million Menschen in Deutschland leiden Schätzungen zufolge schon heute an der Alzheimer-Erkrankung. In den nächsten Jahren könnten es – mit zunehmendem Anteil der älteren Bevölkerungsgruppen – noch deutlich mehr werden. Umso wichtiger wäre eine effektive Behandlungsoption der Gedächtniserkrankung. Doch außer Medikamenten, die die Symptome kurzzeitig und leicht mildern, ist bis heute keine Therapie verfügbar.
Nachdem die US-amerikanische Zulassungsbehörde FDA im Sommer den Wirkstoff Aducanumab unter dem Namen Aduhelm zur Behandlung der Alzheimer-Demenz zugelassen hatte, war die europäische Arzneimittelagentur unter Zugzwang. Der Ausschuss für Humanarzneimittel der EMA prüfte den Zulassungsantrag des Herstellers Biogen. Heute teilte der Ausschuss mit, dass er die Zulassung nicht empfehlen könne.
„Die Daten der beiden Studien, die für diese Entscheidung wichtig waren, waren nicht überzeugend bezüglich der Wirksamkeit“, erklärt Stefan Teipel vom Deutschen Zentrum für Neurodegenerative Erkrankungen, kurz DZNE, in Rostock.
Nachdem die US-amerikanische Zulassungsbehörde FDA im Sommer den Wirkstoff Aducanumab unter dem Namen Aduhelm zur Behandlung der Alzheimer-Demenz zugelassen hatte, war die europäische Arzneimittelagentur unter Zugzwang. Der Ausschuss für Humanarzneimittel der EMA prüfte den Zulassungsantrag des Herstellers Biogen. Heute teilte der Ausschuss mit, dass er die Zulassung nicht empfehlen könne.
„Die Daten der beiden Studien, die für diese Entscheidung wichtig waren, waren nicht überzeugend bezüglich der Wirksamkeit“, erklärt Stefan Teipel vom Deutschen Zentrum für Neurodegenerative Erkrankungen, kurz DZNE, in Rostock.
Nutzen überwiegt nicht die Risiken durch Nebenwirkungen
Die EMA weist in ihrer Begründung der Entscheidung auch auf die Nebenwirkungen der Substanz hin. Aduhelm kann zu Hirnschwellungen und -blutungen führen, die zwar meist erkannt werden und sich wieder zurückbilden, jedoch auch in seltenen Fällen schwer verlaufen können. Der Nutzen von Aduhelm überwiegt daher der EMA zufolge nicht die Risiken, so Teipel: „Meine Meinung ist, dass man die Entscheidung der EMA sehr gut nachvollziehen kann und ehrlicherweise nachvollziehbarer als die Entscheidung der FDA.“
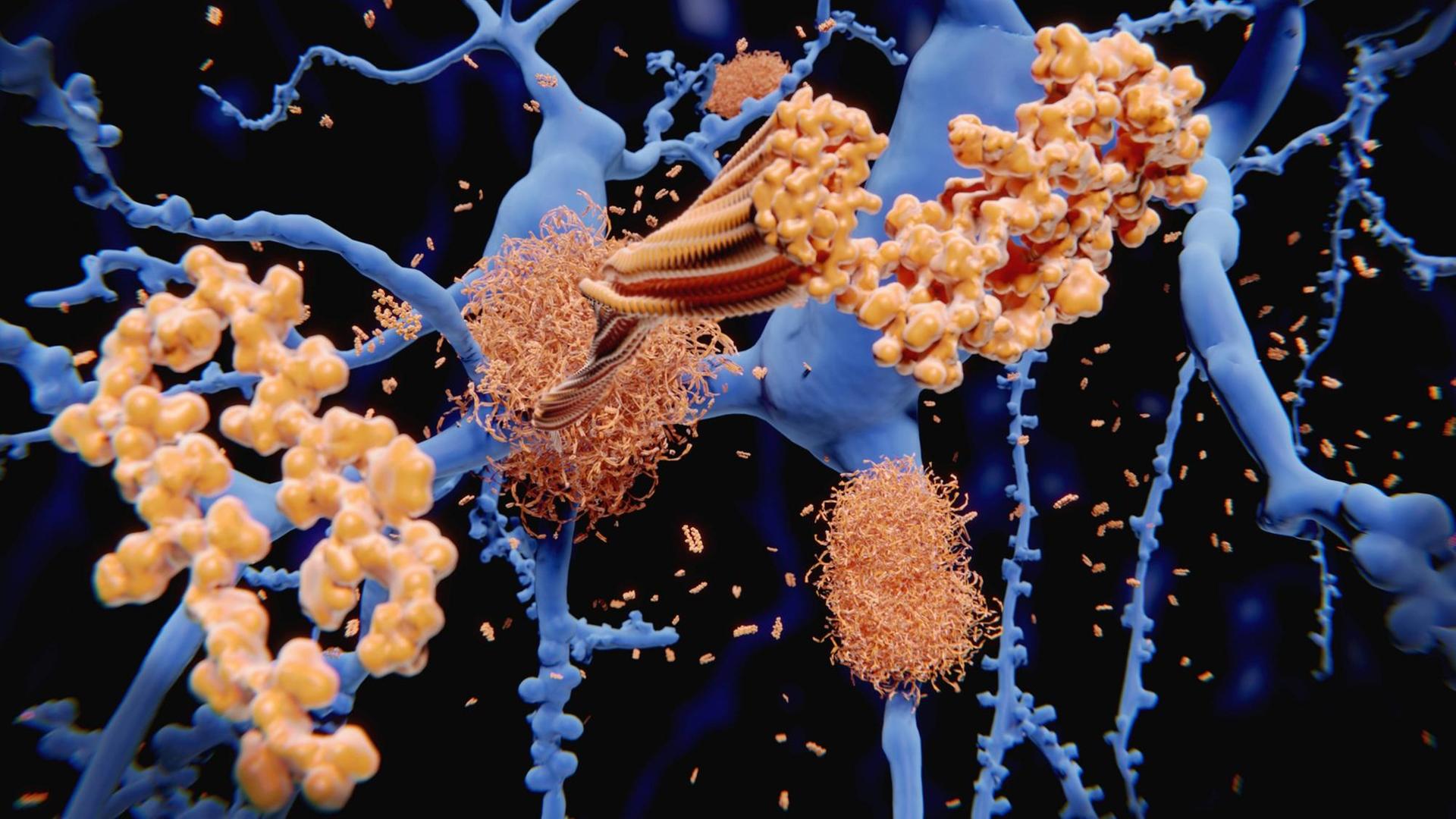
Aducanumab ist ein sogenannter Antikörper-Wirkstoff. Die künstlichen Antikörper markieren ein Eiweiß, das sich bei Alzheimer-Patienten im Gehirn ablagert, das sogenannte Amyloid. Das Immunsystem kann so das Eiweiß entfernen.
Viele Forscher sehen Amyloid am Anfang einer Kaskade, die zum Untergang der Nervenzellen und so schließlich zum Gedächtnisverlust der Patienten führt. Doch mehrere Wirkstoffe, die Amyloid aus dem Gehirn entfernen, haben bislang keine eindeutige Wirkung auf die Gedächtnisleistung von Alzheimer-Patienten gezeigt. Zahlreiche Studien mit diesen Präparaten mussten abgebrochen werden, weil Zwischenanalysen keinen Erfolg bei Fortsetzung der Studien erwarten ließen - so auch die beiden Zulassungsstudien für Aducanumab. Erst eine nachträgliche Auswertung ergab, dass eine bestimmte Patienten-Gruppe in einer der beiden Studien von der Behandlung wohl doch profitierte.
Aducanumab ist ein sogenannter Antikörper-Wirkstoff. Die künstlichen Antikörper markieren ein Eiweiß, das sich bei Alzheimer-Patienten im Gehirn ablagert, das sogenannte Amyloid. Das Immunsystem kann so das Eiweiß entfernen.
Viele Forscher sehen Amyloid am Anfang einer Kaskade, die zum Untergang der Nervenzellen und so schließlich zum Gedächtnisverlust der Patienten führt. Doch mehrere Wirkstoffe, die Amyloid aus dem Gehirn entfernen, haben bislang keine eindeutige Wirkung auf die Gedächtnisleistung von Alzheimer-Patienten gezeigt. Zahlreiche Studien mit diesen Präparaten mussten abgebrochen werden, weil Zwischenanalysen keinen Erfolg bei Fortsetzung der Studien erwarten ließen - so auch die beiden Zulassungsstudien für Aducanumab. Erst eine nachträgliche Auswertung ergab, dass eine bestimmte Patienten-Gruppe in einer der beiden Studien von der Behandlung wohl doch profitierte.
Beschleunigte Zulassung in den USA
Die EMA überzeugte diese unklare Datenlage nicht. Sie geht damit einen anderen Weg als die Regulierungsbehörden in den USA. Deren Entscheidung ist unter Wissenschaftlern sehr umstritten. Sie hat viele Beobachter verwundert, so auch Christian Behl, der an der Universität Mainz zu Demenzerkrankungen forscht: „Letztendlich ist dieses Medikament eher eine Hoffnung als ein erwiesenermaßen erfolgreiches Medikament.“
Obwohl sich auch in den USA ein Beratergremium der FDA mit großer Mehrheit gegen eine Zulassung von Aducanumab ausgesprochen hatte, gab die Arzneimittelbehörde im Juni der Marktzulassung des Medikaments grünes Licht.
Die FDA wählte einen besonderen Weg, die sogenannte beschleunigte Zulassung. Bei diesem Verfahren können Medikamente für besonders schwerwiegende Erkrankungen zugelassen werden, obwohl ihre Wirksamkeit noch nicht eindeutig belegt ist. Die FDA schaut hier mehr auf Studienparameter, die mit den Ursachen der Erkrankung in Zusammenhang stehen könnten. Bei Alzheimer sind das die Amyloid-Eiweiß-Ablagerungen im Gehirn.
„Wenn man einen Antrag stellt, wir wollen ein Medikament zulassen, das Amyloid im Gehirn verringert, dann ist Aducanumab offensichtlich perfekt“, erklärt Christian Behl. Doch Anti-Amyloid-Wirkstoffe hätten einfach bis heute nicht überzeugend gezeigt, dass sich die Gedächtnisleistung der Patienten verbessert. Die Zweifel bei einigen Forschern sind groß, ob es wirklich ausreicht, nur das Amyloid aus dem Gehirn der Patienten zu entfernen.
„Wenn ein Medikament einen Erfolg haben soll, dann muss es eine Erkrankung heilen. Wenn dieses Medikament was tut, dann muss es der Kliniker sehen. Dem Kliniker ist es völlig egal, ob Amyloid da oder weg ist.“
Obwohl sich auch in den USA ein Beratergremium der FDA mit großer Mehrheit gegen eine Zulassung von Aducanumab ausgesprochen hatte, gab die Arzneimittelbehörde im Juni der Marktzulassung des Medikaments grünes Licht.
Die FDA wählte einen besonderen Weg, die sogenannte beschleunigte Zulassung. Bei diesem Verfahren können Medikamente für besonders schwerwiegende Erkrankungen zugelassen werden, obwohl ihre Wirksamkeit noch nicht eindeutig belegt ist. Die FDA schaut hier mehr auf Studienparameter, die mit den Ursachen der Erkrankung in Zusammenhang stehen könnten. Bei Alzheimer sind das die Amyloid-Eiweiß-Ablagerungen im Gehirn.
„Wenn man einen Antrag stellt, wir wollen ein Medikament zulassen, das Amyloid im Gehirn verringert, dann ist Aducanumab offensichtlich perfekt“, erklärt Christian Behl. Doch Anti-Amyloid-Wirkstoffe hätten einfach bis heute nicht überzeugend gezeigt, dass sich die Gedächtnisleistung der Patienten verbessert. Die Zweifel bei einigen Forschern sind groß, ob es wirklich ausreicht, nur das Amyloid aus dem Gehirn der Patienten zu entfernen.
„Wenn ein Medikament einen Erfolg haben soll, dann muss es eine Erkrankung heilen. Wenn dieses Medikament was tut, dann muss es der Kliniker sehen. Dem Kliniker ist es völlig egal, ob Amyloid da oder weg ist.“
Der Bedarf an Alzheimer-Medikamenten ist weiterhin hoch
Die Zulassung der FDA ist an Bedingungen geknüpft: Der Hersteller Biogen muss in den nächsten neun Jahren weitere Daten erheben, die bestätigen, dass Aducanumab den Alzheimer-Patienten tatsächlich hilft. Im Umfeld der überraschenden Entscheidung der FDA warfen zudem Medienberichte über enge Kontakte zwischen Mitarbeitern der Aufsichtsbehörde und der Herstellerfirma Fragen auf. Inzwischen überprüft die Bundesaufsichtsbehörde des US-Gesundheitsministeriums die Vorgänge.
Die EMA hat sich nun anders entschlossen und so vermutlich eine ähnlich polarisierende Kontroverse wie in den USA vermieden. Obwohl auch in Europa der Bedarf an einer Alzheimer-Therapie groß ist. „Es wird höchste Eisenbahn, dass endlich mal nach Jahrzehnten wieder was auf den Markt kommt, was vielleicht ein bisschen zumindest ein Silberstreif am Horizont ist“, erklärt Christian Haass, der am DZNE in München an der Alzheimer-Erkrankung forscht.
Die Entscheidung von heute wird jedoch nicht die letzte in Bezug auf Anti-Amyloid-Wirkstoffe sein. Zwei weitere Medikamente, die auf einem ähnlichen Prinzip wie Aducanumab beruhen, hatten zuletzt in vorläufigen Studienauswertungen gute Ergebnisse gezeigt – laut den Herstellern auch auf die Gedächtnisfunktionen der Patienten. Schon nächstes Jahr könnten hier neue Entscheidungen bei den Zulassungsbehörden anstehen.
Biogen kann zudem nun innerhalb von 15 Tagen nach Erhalt des Gutachtens der EMA eine erneute Prüfung beantragen.
Die EMA hat sich nun anders entschlossen und so vermutlich eine ähnlich polarisierende Kontroverse wie in den USA vermieden. Obwohl auch in Europa der Bedarf an einer Alzheimer-Therapie groß ist. „Es wird höchste Eisenbahn, dass endlich mal nach Jahrzehnten wieder was auf den Markt kommt, was vielleicht ein bisschen zumindest ein Silberstreif am Horizont ist“, erklärt Christian Haass, der am DZNE in München an der Alzheimer-Erkrankung forscht.
Die Entscheidung von heute wird jedoch nicht die letzte in Bezug auf Anti-Amyloid-Wirkstoffe sein. Zwei weitere Medikamente, die auf einem ähnlichen Prinzip wie Aducanumab beruhen, hatten zuletzt in vorläufigen Studienauswertungen gute Ergebnisse gezeigt – laut den Herstellern auch auf die Gedächtnisfunktionen der Patienten. Schon nächstes Jahr könnten hier neue Entscheidungen bei den Zulassungsbehörden anstehen.
Biogen kann zudem nun innerhalb von 15 Tagen nach Erhalt des Gutachtens der EMA eine erneute Prüfung beantragen.